Слайд 2Ответить на вопросы
Какие вещества называют восстановителями? Что происходит с их степенью окисления?
Приведите

примеры важнейших восстановителей, из простых веществ и сложных веществ.
Отчего зависит восстановительные способности веществ?
Слайд 3Ответить на вопросы
Какие вещества называют окислителями? Что происходит с их степенью окисления

при химических реакциях?
Какие вещества проявляют окислительные свойства? Приведите примеры.
От чего зависят окислительные свойства ?
Слайд 4Ответить на вопросы
Назовите основные типы окислительно-восстановительных реакций.
Приведите примеры реакций:
а) межмолекулярные,

б) внутримолекулярные,
в) диспропорционирования
Слайд 5Выполнить упражнения
Выбрать из реакций окислительно-восстановительные, расставить степени окисления всех элементов, определить

тип окислительно - восстановительной реакции, указать окислитель и восстановитель.
Cu(OH)2 → CuO + H2O
Cu(NO3)2 → CuO + NO2 + O2
HNO2 → NO + NO2 + H2O
P + CI2 → PCI5
H2O + SO2 → H2SO3
Ca(OH)2 +CO2 → CaCO3 + H2O
Слайд 6Электролиз
- это окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через
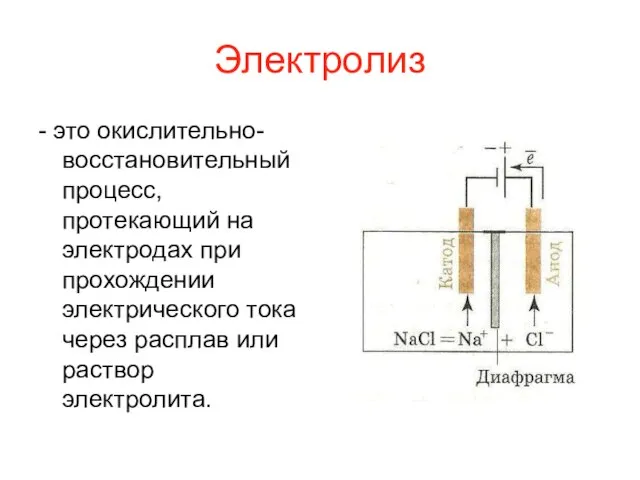
расплав или раствор электролита.
Слайд 7Электролиз расплавов
Подвергаются: щелочи, термически устойчивые соли, оксиды металлов.

Слайд 9Электролиз растворов
Порядок разрядки анионов
В первую очередь разряжаются бескислородные ионы: S2-, I-, Br-,

CI- и анионы органических кислот 2RCOO- - 2e→ 2CO2 + R-R.
Во вторую очередь разряжается гидроксид-ион (в щелочной среде): 4OH- - 4e → O2 + 2H2O или вода (в кислой и нейтральной среде) 2H2O – 4e → O2 + 4H+.
В растворе не разряжаются анионы кислородсодержащих кислотных остатков и фторид-ион.
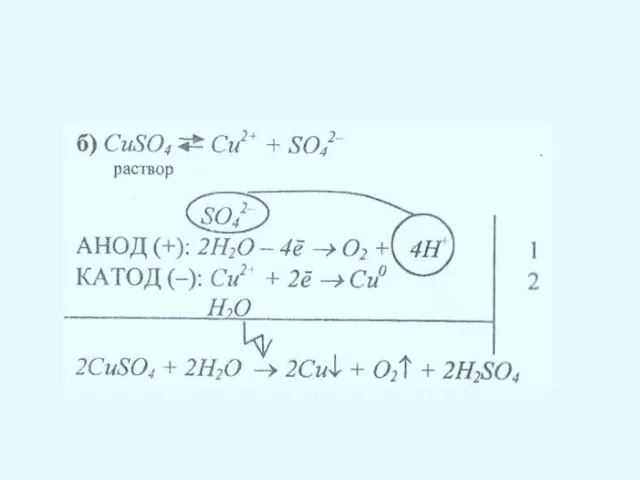
Слайд 10Электролиз раствора
Порядок разрядки катионов
В первую очередь на катоде разряжаются катионы металлов, стоящих

в ряду напряжений металлов после водорода.
Во вторую очередь в кислотной среде разряжаются катионы водорода: 2H+ + 2e → H2 или вода (в нейтральной и щелочной среде) 2H2O+2e → H2+OH-
Одновременно с водой могут разряжаться катионы металлов стоящих в ряду напряжений от алюминия до водорода.
В растворах никогда не разряжаются катионы металлов, стоящих в ряду напряжений до алюминия (включительно).











 e169ef73a24f42198b95276fd042e8b8
e169ef73a24f42198b95276fd042e8b8 Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов
Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов Презентация на тему Полисахариды
Презентация на тему Полисахариды  Физические свойства спиртов
Физические свойства спиртов Презентация на тему Общая характеристика металлов главных подгрупп I-III
Презентация на тему Общая характеристика металлов главных подгрупп I-III  Презентация на тему Алкадиены: строение, номенклатура, гомологи, изомерия
Презентация на тему Алкадиены: строение, номенклатура, гомологи, изомерия  Углеводороды. Изомеры и гомологи
Углеводороды. Изомеры и гомологи Фуллерены
Фуллерены Химия окислительновосстановительные реакции
Химия окислительновосстановительные реакции Амины. Аминокислоты. Белки
Амины. Аминокислоты. Белки Карбоновые кислоты
Карбоновые кислоты Типы химических связей
Типы химических связей Строение вещества. Химическая связь
Строение вещества. Химическая связь Презентация на тему В мире индикаторов - исследовательская работа
Презентация на тему В мире индикаторов - исследовательская работа  Серная кислота и её соли. Качественная реакция на сульфат-ион
Серная кислота и её соли. Качественная реакция на сульфат-ион Аэрированный сшитый полимерный раствор (АСПР)
Аэрированный сшитый полимерный раствор (АСПР) Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Химическое равновесие в растворах электролитов
Химическое равновесие в растворах электролитов Природные источники углеводородов. Нефть и природный газ
Природные источники углеводородов. Нефть и природный газ Строение и номенклатура карбонильных соединений
Строение и номенклатура карбонильных соединений Три секрета прочности волокнистых композитов
Три секрета прочности волокнистых композитов Виды работ на уроках химии
Виды работ на уроках химии Кетоны. Номенклатура
Кетоны. Номенклатура Пробоотбор и пробоподготовка
Пробоотбор и пробоподготовка Презентация на тему Нефть. Свойства, состав, переработка
Презентация на тему Нефть. Свойства, состав, переработка  Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Строение и свойства циклоалканов
Строение и свойства циклоалканов Сероводород. Сульфиды
Сероводород. Сульфиды