Содержание
- 2. Цели урока Образовательная -- рассмотрение строения атома, аллотропии углерода; формирование представлений о строении, свойствах и применении
- 3. План работы : 1. Общая характеристика элементов IY группы главной подгруппы по положению в периодической системе
- 4. +6С )2)4 +14Si )2)8)4 +32Ge )2)8)18)4 +50Sn )2)8)18)18)4 +82Pb )2)8)18)32)18)4 Общая электронная формула внешнего слоя S2
- 5. Задание: Пользуясь периодической системой химических элементов Д.И.Менделеева, дайте сравнительную характеристику химических элементов главной подгруппы IY группы,
- 6. Строение атомов химических элементов углерода и кремния
- 7. Изменение свойств в группе С Si Ge Sn Pb Металлические свойства увеличиваются ВЫВОД
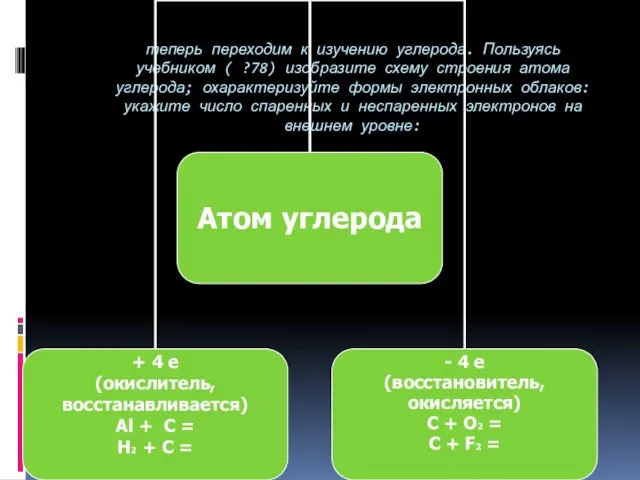
- 8. Порядковый номер – 6 Строение атома: протонов – 6, нейтронов – 6, электронов – 6 Энергетических
- 9. теперь переходим к изучению углерода. Пользуясь учебником ( ?78) изобразите схему строения атома углерода; охарактеризуйте формы
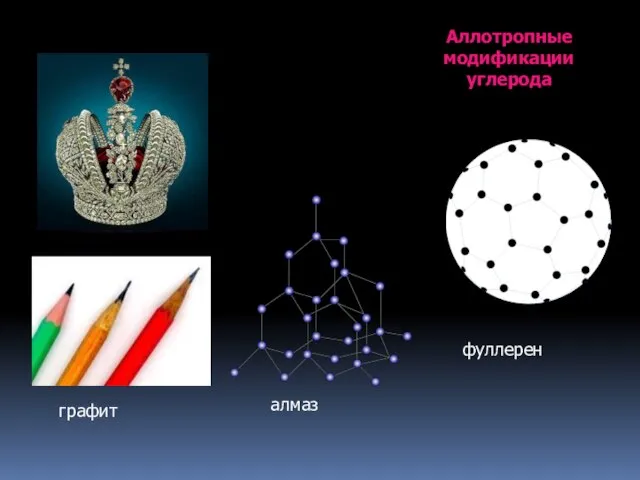
- 10. Аллотропные модификации углерода графит алмаз фуллерен
- 11. Г Р А Ф И Т Применение графита: Электроды для электролиза Облицовка сопел ракетных двигателей Смазка
- 12. П О Ч Е М У А Л М А З - очень твердый, Г Р
- 13. А Л М А З Алмаз имеет атомную кристаллическую решетку, в которой каждый атом углерода связан
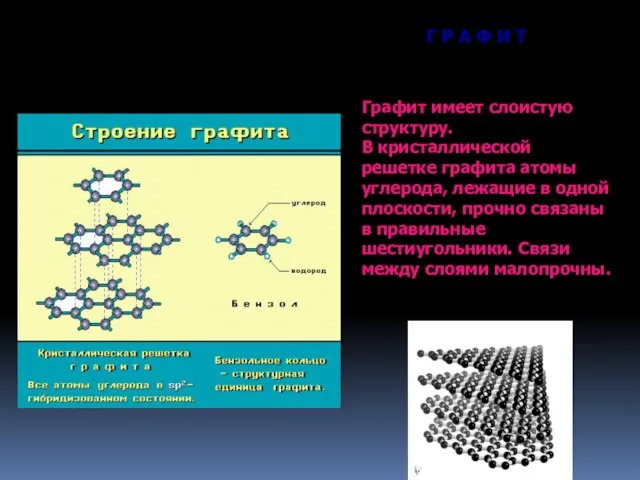
- 14. Г Р А Ф И Т Графит имеет слоистую структуру. В кристаллической решетке графита атомы углерода,
- 15. Г Р А Ф И Т Сходное с графитом строение имеют: Сажа Древесный уголь Кокс типографская
- 16. Н.Д.Зелинский
- 17. Угольные фильтры В бытовых фильтрах, в промышленном производстве, на очистных сооружениях – уголь поглощает вредные вещества
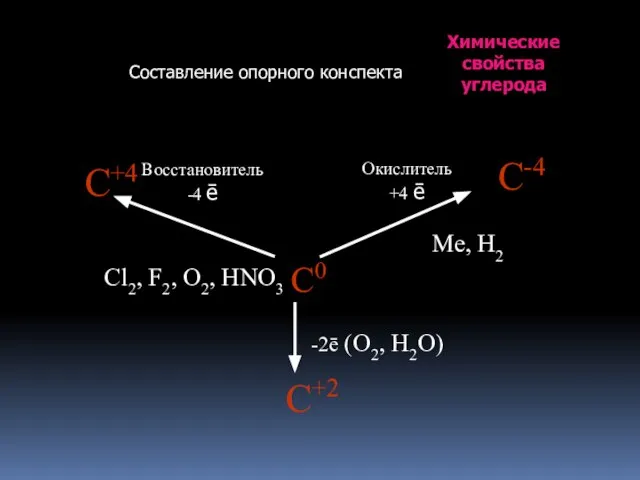
- 18. Химические свойства углерода Составление опорного конспекта
- 19. Т е с т 1. Конфигурация внешнего электронного уровня элементов подгруппы углерода: а) ns2np2 б) ns2np3
- 20. ПРОВЕРЬ ПОЛУЧЕННЫЕ ЗНАНИЯ Ответы к тесту 1.а; 2.в; 3.а; 4.б; 5.в; 6.а; 7.в
- 21. Это интересно: АЛМАЗНЫЙ ФОНД Российской Федерации, государственное собрание драгоценных камней и ювелирных изделий, имеющих историческую, художественную
- 22. Это интересно: Держава и Большой бриллиантовый букет
- 23. Это интересно: Алмаз «Шах». В 1829 году поднесен персидским шахом Хозрев-Мирзой Николаю I как выкуп за
- 24. Колумбийский изумруд и Цейлонский сапфир Это интересно:
- 25. Портретный алмаз Это интересно:
- 26. Промышленные месторождения связаны с кимберлитами, россыпями. Главные зарубежные добывающие страны: ЮАР, Конго (Заир), Ботсвана, Намибия. В
- 27. Обобщение пройденного материала: Какие элементы Периодической системы входят в главную подгруппу IV группы? Что общего в
- 28. Закрепление. Тестовая работа по вариантам. 1. В IV группе главной подгруппы в периодической системе Д.И.Менделеева расположены
- 29. 6. Из аллотропных видоизменений углерода (sp3 гибридизация) наибольшую твердость проявляет: А) Уголь; Б) Графит; В) Алмаз;
- 31. Скачать презентацию























 Биологическое значение брома и йода
Биологическое значение брома и йода Природные источники углеводородов
Природные источники углеводородов Презентация на тему Электролиз: что полезно знать
Презентация на тему Электролиз: что полезно знать  Гидрокрекинг нефтяного сырья
Гидрокрекинг нефтяного сырья Изомерия
Изомерия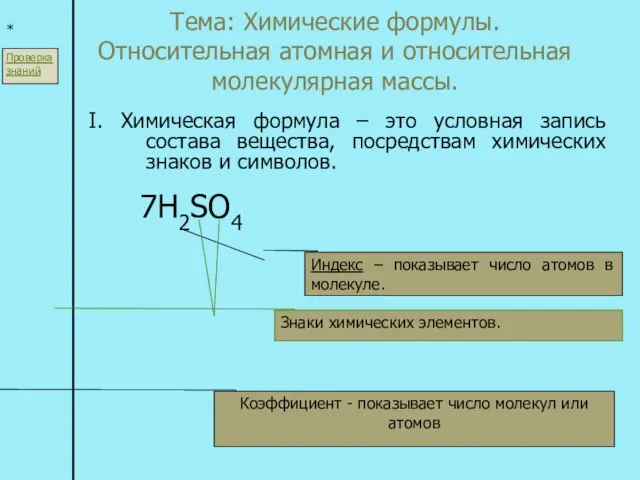 Тема: Химические формулы. Относительная атомная и относительная молекулярная массы. I. Химическая формула – это условная запись с
Тема: Химические формулы. Относительная атомная и относительная молекулярная массы. I. Химическая формула – это условная запись с Структура металлов, сплавов, интерметаллидов и квазикристаллов
Структура металлов, сплавов, интерметаллидов и квазикристаллов Санитарно-гигиенические показатели питьевой воды
Санитарно-гигиенические показатели питьевой воды Измеритель концентрации асфальтенов в нефти с погружной решёткой Брэгга
Измеритель концентрации асфальтенов в нефти с погружной решёткой Брэгга Вариативные задачи по химии различных типов в тестовой форме
Вариативные задачи по химии различных типов в тестовой форме Сложные эфиры. Жиры
Сложные эфиры. Жиры Алканы. Химические совйства
Алканы. Химические совйства Альдегиды
Альдегиды Презентация на тему Кислоты
Презентация на тему Кислоты  Фосфор. Урок в 9 классе
Фосфор. Урок в 9 классе ОВР
ОВР Кислоты. Строение, классификации и свойства неорганических кислот
Кислоты. Строение, классификации и свойства неорганических кислот Нефть. Свойства нефти
Нефть. Свойства нефти Закон сохранения массы веществ. Уравнения химических реакций.
Закон сохранения массы веществ. Уравнения химических реакций. Ароматические углеводороды. Бензол
Ароматические углеводороды. Бензол Пластификация пластмасс
Пластификация пластмасс Технология синтеза КТ CdSe
Технология синтеза КТ CdSe Синтез и свойства кукурбитурилов
Синтез и свойства кукурбитурилов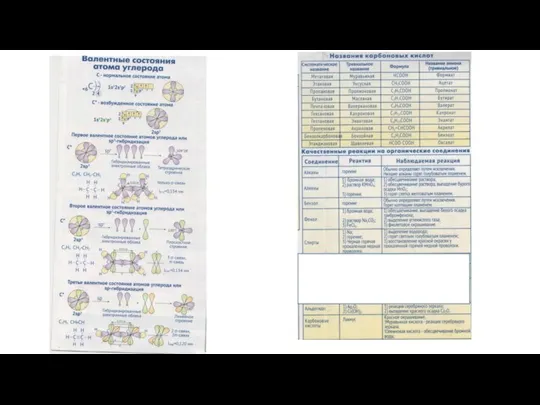 Валентные состояния атома углерода
Валентные состояния атома углерода Галогеноалканы: получение, свойства и применение
Галогеноалканы: получение, свойства и применение Углерод 9 класс Подготовила учитель химии СШ№16 Самойлова Регина Львовна
Углерод 9 класс Подготовила учитель химии СШ№16 Самойлова Регина Львовна Кислоты
Кислоты Органическая химия
Органическая химия