Слайд 2Распространенность металлов в природе
Содержание некоторых металлов в земной коре:
Алюминий 8,2%
Железо 5,0%
Кальций 4,1%
Натрий

2,3%
Магний 2,3%
Калий 2,1%
Слайд 3Распространенность металлов в природе
Содержание некоторых металлов в морской воде:
Na+ 1,05%
Mg 2+ 0,12%

Слайд 4В природе металлы могут встречаться
Только в свободном (самородном) виде (благородные металлы -

золото, платина);
В самородном виде и в виде соединений (металлы малой активности – серебро, медь, ртуть, олово);
Только в виде соединений (металлы, стоящие в ряду напряжений до олова).
Слайд 11Чаще всего металлы встречаются в виде
Солей неорганических кислот
Оксидов

Слайд 12Сульфиды
Галенит PbS
Киноварь HgS
Пирит FeS2
И др.

Слайд 13Хлориды
Сильвин KCl
Галит NaCl
Сильвинит KCl • NaCl
Карналлит
KCl • MgCl2 • 6H2O
И

др.
Слайд 14Сульфаты, фосфаты, карбонаты
Барит BaSO4
Апатит Ca5(PO4)3(F,CI)
Мрамор CaCO3
Магнезит MgCO3
Малахит Cu2(OH)2CO3
И др.

Слайд 15Оксиды
Магнетит Fe3O4
Гематит Fe2O3
Каолин Al2O3 • 2SiO2 • 2H2O
И др.

Слайд 16
Минералы и горные породы, содержащие металлы и их соединения и пригодные для

промышленного получения металлов, называются рудами.
Отрасль промышленности, занимающаяся получением металлов из руд, называется металлургией.
Слайд 181. Пирометаллургия
Восстановление металлов из руд при высоких температурах с помощью восстановителей.
Соль

→ оксид
Соли кислородсодержащих кислот – термическое разложение:
CuCO3 = CuO + CO2
Соли бескислородных кислот- обжиг:
2ZnS + ЗО2 = 2ZnО + 2SО2
Слайд 19Восстановление углем или угарным газом:
CuO + C → Cu + CO
CuO +

CO → Cu + CO2
Водородотермия:
Cr2O3 + H2 → Cr + H2O
Металлотермия:
Fe2O3 + Al → Fe + Al2O3
t
t
t
t
Слайд 202. Гидрометаллургия
Получение металлов из растворов их солей.
Перевод нерастворимого соединения в раствор:
CuO +

H2SO4 = CuSO4 + H2O
Восстановление металла из раствора:
CuSO4 + Fe = FeSO4 + Cu.


















 Нефть. Состав, свойства, переработка
Нефть. Состав, свойства, переработка Сравнение свойств неорганических и органических веществ
Сравнение свойств неорганических и органических веществ Жири. Склад жирів, фізичні властивості. Природні й гідрогенізовані жири. Біологічна роль жирів
Жири. Склад жирів, фізичні властивості. Природні й гідрогенізовані жири. Біологічна роль жирів Изучение зависимости скорости химической реакции от различных факторов. Практическая работа № 6
Изучение зависимости скорости химической реакции от различных факторов. Практическая работа № 6 Эмпирические правила
Эмпирические правила Получение галогеноалканов
Получение галогеноалканов Алканы 10-класс
Алканы 10-класс Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Понятие о спиртах
Понятие о спиртах Оптические свойства ювелирных камней. Цвет плеохроизм. Часть 1
Оптические свойства ювелирных камней. Цвет плеохроизм. Часть 1 Классификация неорганических соединений
Классификация неорганических соединений Химические уравнения
Химические уравнения Водород. Вода
Водород. Вода Атомы химических элементов
Атомы химических элементов Серная кислота. Свойства серной кислоты
Серная кислота. Свойства серной кислоты Приложения для отслеживания проб ALS Geochemistry
Приложения для отслеживания проб ALS Geochemistry Предмет органической химии
Предмет органической химии Презентация по Химии "Sulfur"
Презентация по Химии "Sulfur"  Классификация методов аналитической химии
Классификация методов аналитической химии Химическая связь
Химическая связь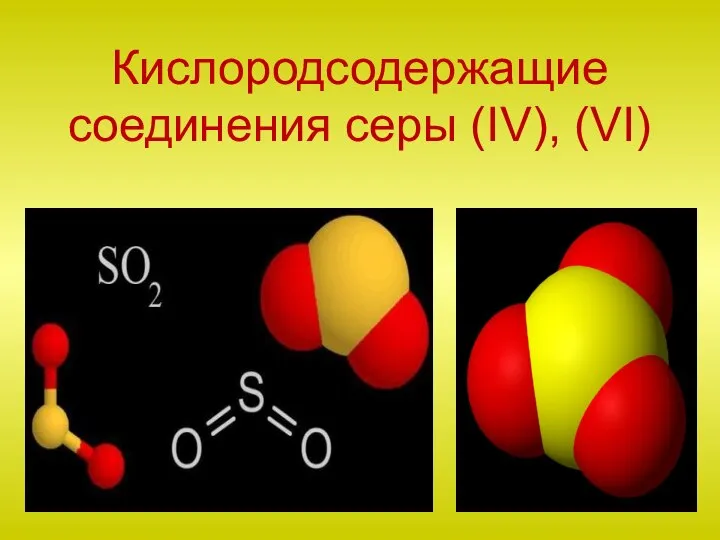 Кислородсодержащие соединения серы (IV), (VI)
Кислородсодержащие соединения серы (IV), (VI) Алкены
Алкены Поликарбонат мономерлері
Поликарбонат мономерлері Презентация на тему Химия в криминалистике
Презентация на тему Химия в криминалистике  Железо и его соединения
Железо и его соединения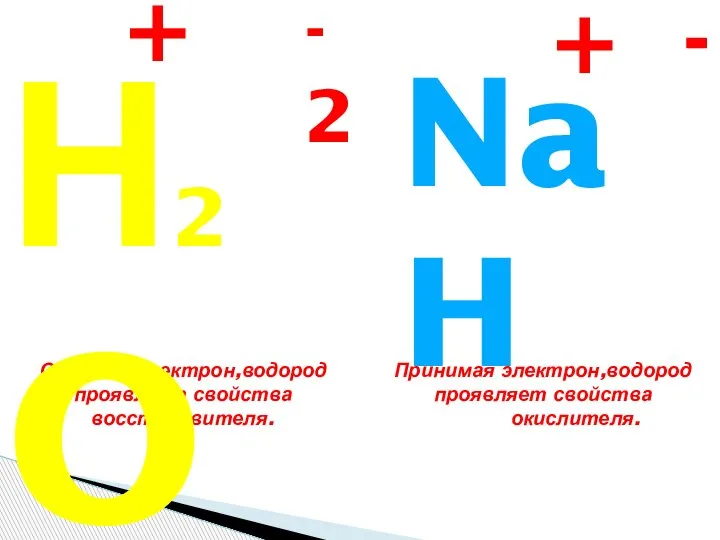 Кислород и водород
Кислород и водород Электролитическая диссоциация
Электролитическая диссоциация Метод валентных связей
Метод валентных связей