Содержание
- 2. Элемент, о котором пойдет речь на уроке, А.Е. Ферсман назвал “элементом мысли”. Открыт этот элемент в
- 3. Фосфор был открыт немецким алхимиком X. Брэндом в 1669 г. Позже А. Лавуазье доказал, что фосфор
- 4. период Фосфор как химический элемент III группа VА валентных электронов 5 степени окисления -3, +3, +5
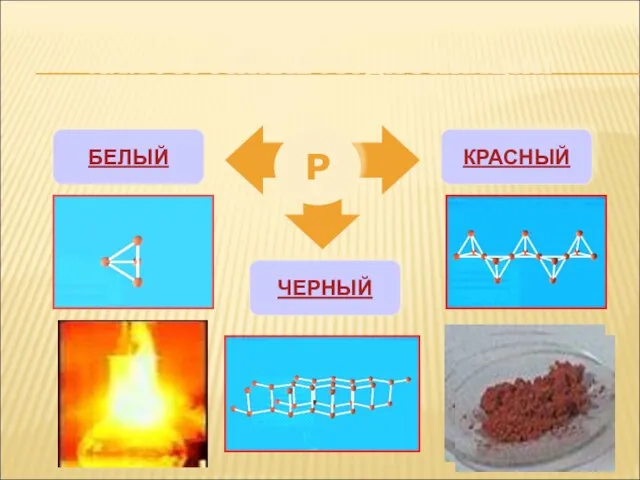
- 5. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ Р БЕЛЫЙ КРАСНЫЙ ЧЕРНЫЙ
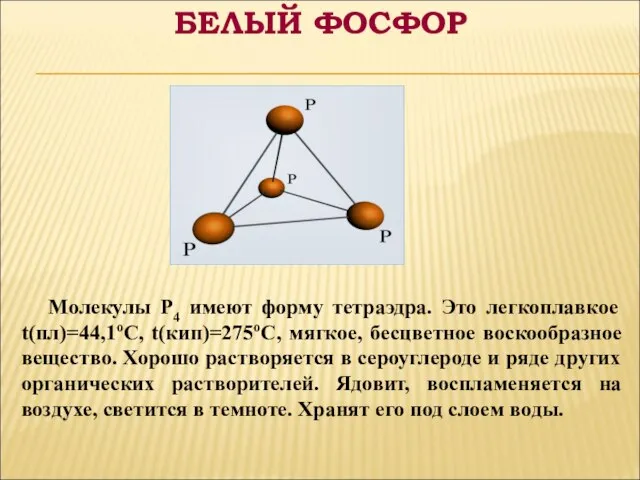
- 6. Молекулы P4 имеют форму тетраэдра. Это легкоплавкое t(пл)=44,1оС, t(кип)=275оС, мягкое, бесцветное воскообразное вещество. Хорошо растворяется в
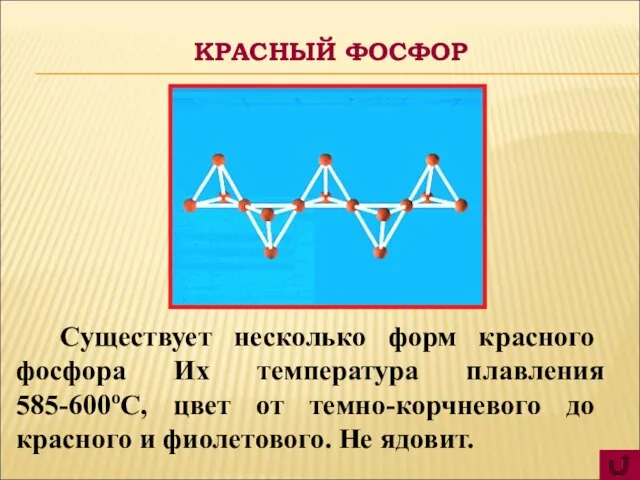
- 8. Существует несколько форм красного фосфора Их температура плавления 585-600оС, цвет от темно-корчневого до красного и фиолетового.
- 10. Черный фосфор имеет слоистую атомную кристаллическую решетку. По внешнему виду похож на графит, но является полупроводником.
- 12. Белый фосфор легко окисляется и самовоспламеняется на воздухе, поэтому его хранят под водой. Красный фосфор не
- 13. ХИМИЧЕСКИЕ СВОЙСТВА С металлами: Ca + P = C неметаллами: P + O2 = P +
- 14. с бертолетовой солью при ударе взрывается, воспламеняется: KClO3 + P = P2O5 + KCl
- 15. В промышленности фосфор получают из фосфоритов и апатитов, нагревая их в электрической печи без доступа воздуха
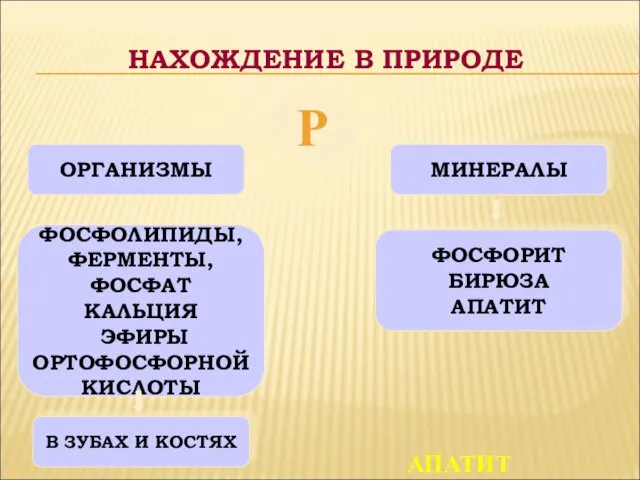
- 16. Р ОРГАНИЗМЫ МИНЕРАЛЫ ФОСФОЛИПИДЫ, ФЕРМЕНТЫ, ФОСФАТ КАЛЬЦИЯ ЭФИРЫ ОРТОФОСФОРНОЙ КИСЛОТЫ В ЗУБАХ И КОСТЯХ ФОСФОРИТ БИРЮЗА
- 17. НАХОЖДЕНИЕ ФОСФОРА В ПРИРОДЕ. В земной коре содержится около 0,08% фосфора. В природе фосфор содержится в
- 18. ФОСФОР В ОРГАНИЗМЕ ЧЕЛОВЕКА. Фосфор входит в состав белковых веществ в виде различных соединений. Содержание фосфора
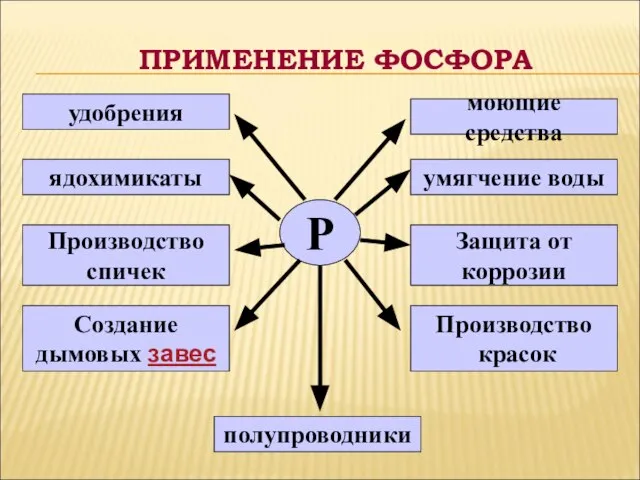
- 19. ПРИМЕНЕНИЕ ФОСФОРА Р удобрения ядохимикаты Производство спичек Создание дымовых завес полупроводники Производство красок Защита от коррозии
- 21. Скачать презентацию













 Строение органических соединений
Строение органических соединений Презентация на тему Лекарства дома
Презентация на тему Лекарства дома  Изготовление слайма в домашних условиях
Изготовление слайма в домашних условиях Кислотно-основные равновесия
Кислотно-основные равновесия Ионообменная хроматография в разделении белков
Ионообменная хроматография в разделении белков Металлы. 9 класс
Металлы. 9 класс Соли. Свойства. Получение
Соли. Свойства. Получение Фармаколого-фармакогностическое исследование биологически активных добавок, применяемых для похудения
Фармаколого-фармакогностическое исследование биологически активных добавок, применяемых для похудения Химия. Соотечественники, внёсшие большой вклад в становление и развитие этой науки
Химия. Соотечественники, внёсшие большой вклад в становление и развитие этой науки Термохимия
Термохимия Металлы и их соединения
Металлы и их соединения Рефолдинг миниантител
Рефолдинг миниантител Химические свойства оксидов
Химические свойства оксидов Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Вещество. Свойства веществ
Вещество. Свойства веществ Современное представление о строении атома, S- и P- орбитали
Современное представление о строении атома, S- и P- орбитали Реакции Фаворского
Реакции Фаворского Масс-спектрометрические методы определения газового состава
Масс-спектрометрические методы определения газового состава Промышленный метод получения ацетилена
Промышленный метод получения ацетилена Силикатная промышленность
Силикатная промышленность Современные способы защиты ОТТ
Современные способы защиты ОТТ Вещества простые и сложные
Вещества простые и сложные Получение меди
Получение меди Введение в органическую химию. Классификация органических соединений
Введение в органическую химию. Классификация органических соединений Презентация на тему Палладий
Презентация на тему Палладий  Чугуны
Чугуны Презентация на тему Оксиды
Презентация на тему Оксиды  Основные классы неорганических соединений
Основные классы неорганических соединений