Слайд 2Тема урока: Соединения галогенов
Цель урока: ознакомить учащихся с основными соединениями галогенов
Задачи:
Состав и

свойства галогеноводородов
Получение галогеноводородов
Изучение свойств соляной кислоты
Соли галогеноводородных кислот
Слайд 3Этапы урока
Водородные соединения галогенов (учащиеся используют ПС, таблицу растворимости)
Получение хлороводорода в лаборатории

(демонстрационный опыт)
Общие свойства соляной кислоты (ученический эксперимент)
Соли галогеноводородов (составляют химические формулы, определяют растворимость, качественный реактив)
Применение знаний
Слайд 4Тип урока: проблемно- поисковый
Вид деятельности:
словесный, аналитический, размышление,
экспериментальный
Знания: закрепление

знаний о соединениях
галогенов –кислоты, соли
Умения: анализировать новую информацию
с ранее изученной, делать самостоятельно выводы
Навыки: связь теоретических знаний с результатами
эксперимента, развитие техники лабораторной работы
Актуальность: использование знаний
на уроках химии, в повседневной жизни
Новизна: эксперимент - микрометод
Слайд 5План урока
Водородные соединения галогенов
Получение хлороводорода в лаборатории (демонстрационный опыт)
Общие свойства соляной кислоты

(ученический эксперимент)
Соли галогеноводородов
Применение знаний
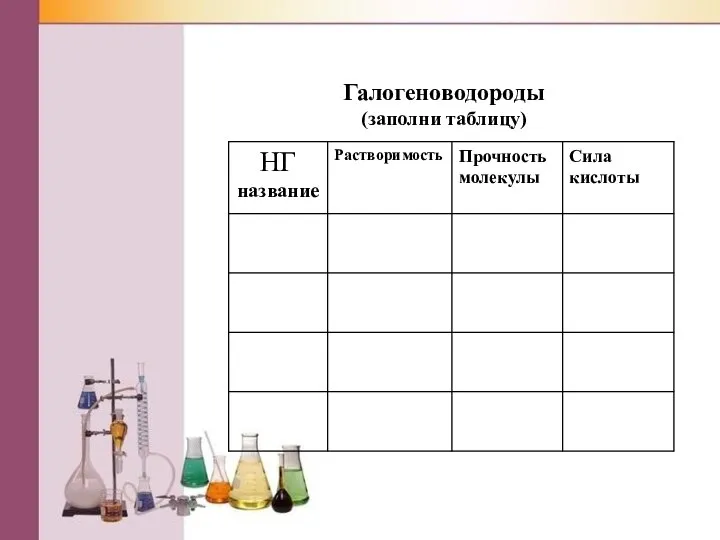
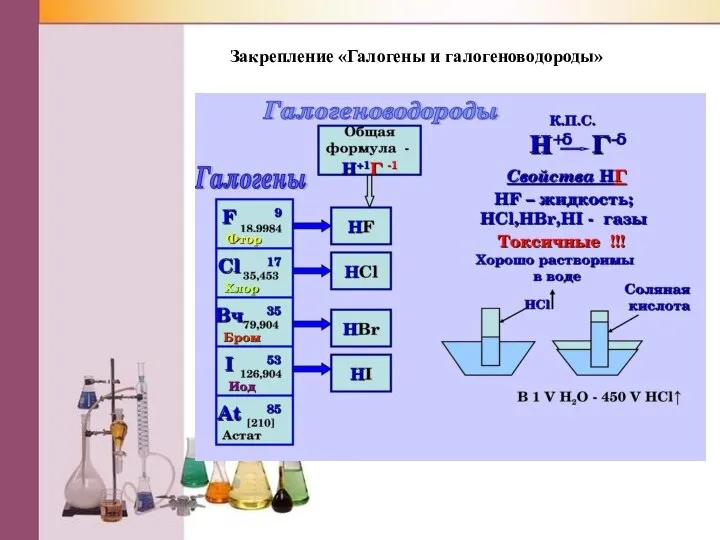
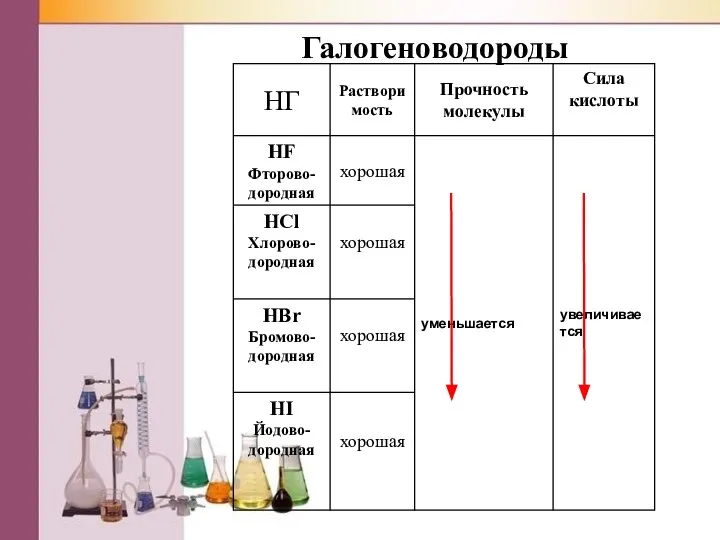
Слайд 6Галогеноводороды
(заполни таблицу)
Слайд 8Соляная кислота- HCl
Соляная кислота – бесцветная, дымящая на воздухе жидкость
(в продажу поступает

36% раствор хлороводорода в воде)
несколько тяжелее воды (плотность 1.19 г/мл)
Слайд 9Способы получения хлороводорода
В лаборатории (рис.1)
В промышленности (рис.2)
Рис.1 Рис.2

Слайд 10Уравнения химических реакций получения хлороводорода
1. NaCl (кр.) + H2SO4(конц.)=
NaHSO4+HCl
2. H2 +

Cl2 =2HCl
Слайд 11Свойства соляной кислоты
Взаимодействие HCl c веществами различных классов

Слайд 12Свойства соляной кислоты
c веществами каких классов
реагирует

Слайд 13УЧЕНИЧЕСКИЙ ЭКСПЕРИМЕНТ
Общие свойства соляной кислоты
1.Соблюдай технику безопасности при работе с кислотами и

щелочами!!!
2. Проведи химические реакции с предложенными на керамической пластинке реагентами и соляной кислотой
3. Результаты и наблюдения впиши в таблицу
Слайд 14Ученический эксперимент
«Общие свойства соляной кислоты»
1.Соблюдай технику безопасности при работе с кислотами и
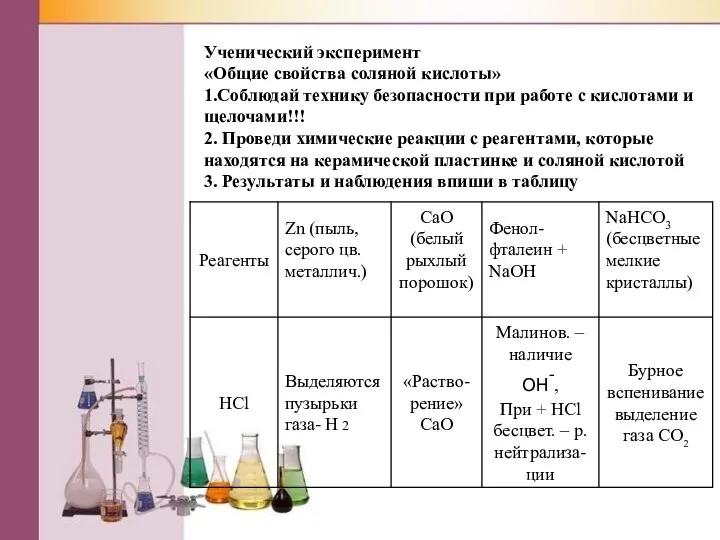
щелочами!!!
2. Проведи химические реакции с реагентами, которые находятся на керамической пластинке и соляной кислотой
3. Результаты и наблюдения впиши в таблицу
Слайд 15
Проверь уравнения:
1. Zn +2HCl= ZnCl2 + H2
Zn0 + 2H+ = Zn 2+
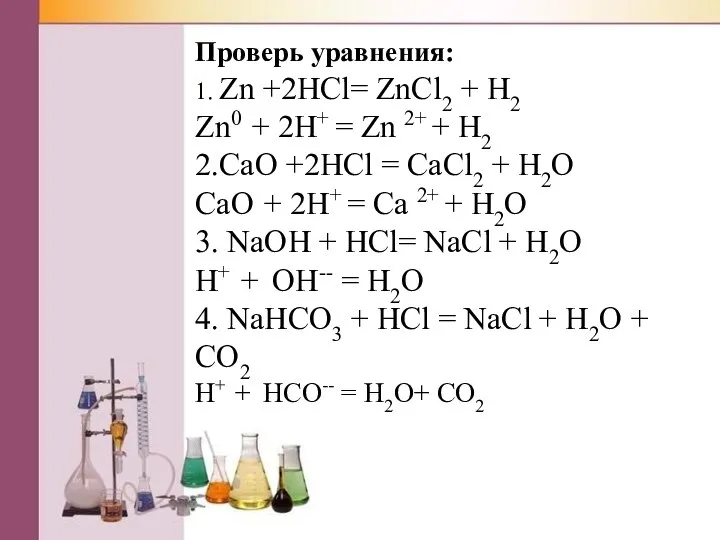
+ H2
2.CaO +2HCl = CaCl2 + H2O
CaO + 2H+ = Ca 2+ + H2O
3. NaOH + HCl= NaCl + H2O
H+ + OН-- = H2O
4. NaHCO3 + HCl = NaCl + H2O + CO2
H+ + НCO-- = H2O+ CO2
Слайд 17Соли галогеноводородных кислот и их обнаружение
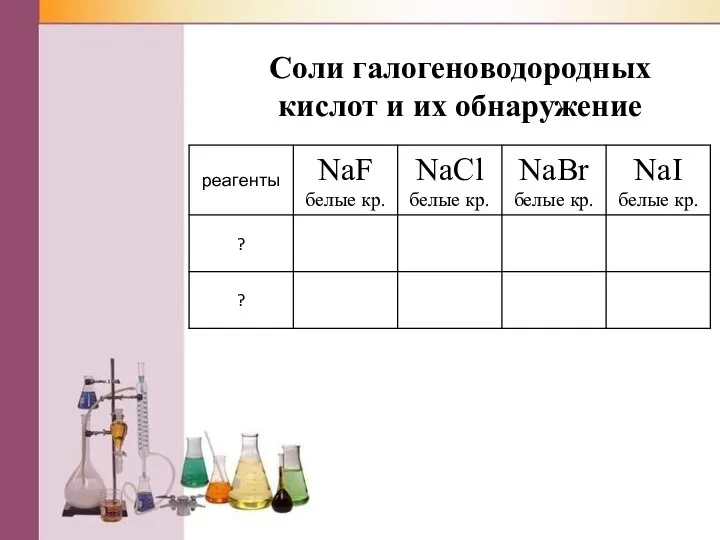
Слайд 18Соли галогеноводородных кислот и их определение.

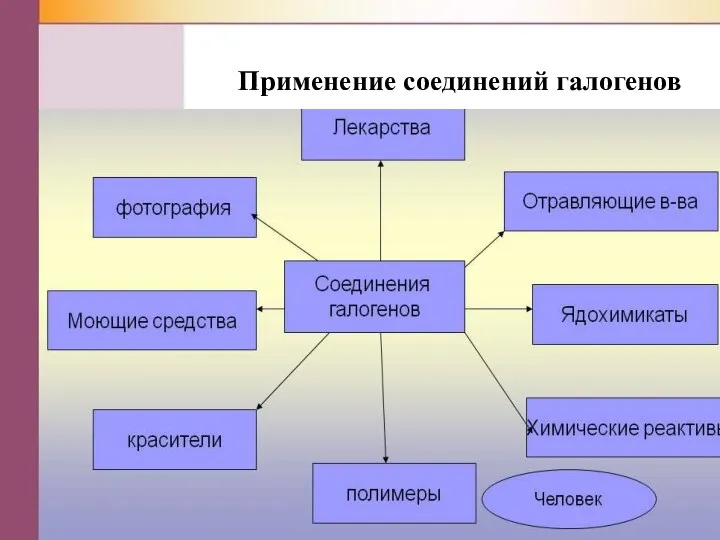
Слайд 19Применение знаний урока
при изучении последующих тем курса химии;
на контрольной работе;
при сдаче

ОГЭ;
в повседневной жизни.
Слайд 20Закрепление «Галогены и галогеноводороды»
Слайд 22Задания из ОГЭ 2017
1. В реакцию с соляной кислотой вступает:
нитрат серебра 2)

нитрат калия 3) серебро 4) оксид кремния
2. Какое сокращённое ионное уравнение соответствует взаимодействию соляной кислоты с оксидом меди(ІІ)?
1) Cu2+ + H+ = CuCl2 + H2O 2) CuO + 2 H+ = Cu2+ + H2O
3) Cu(OH)2 + 2H+ = Cu2+ + 2 H2O 4) CuO + H+ = Cu2+ + 2 H2O
3. С помощью какого реактива можно различить растворы веществ NaCl и NaNO3?
1) лакмус 2) AgNO3 3) H2SO4 4)фенолфталеин
Слайд 23Ответы к заданиям ОГЭ 2017
1)AgNO3+HCl =AgCl + HNO3
2) CuO + 2 H+

= Cu2+ + H2O
3) AgNO3+NaCl =AgCl + HNO3



















 Согласованное и несогласованное действие заместителей в бензольном кольце
Согласованное и несогласованное действие заместителей в бензольном кольце Окислительно-восстановительные реакции
Окислительно-восстановительные реакции ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКИНОВ
ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКИНОВ Общие химические свойства металлов
Общие химические свойства металлов Понятия и законы в химии. (Лекция 1)
Понятия и законы в химии. (Лекция 1) Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Презентация на тему: Азотная кислота
Презентация на тему: Азотная кислота Процесс диссоциации
Процесс диссоциации Количество вещества
Количество вещества Углерод. Электронная формула
Углерод. Электронная формула Водородная химическая связь
Водородная химическая связь Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева
Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева Анодное растворение mn5si3-электрода в сернокислом фторидсодержащем электролите
Анодное растворение mn5si3-электрода в сернокислом фторидсодержащем электролите Техника безопасности при использовании различных видов топлива. Практическая работа № 3
Техника безопасности при использовании различных видов топлива. Практическая работа № 3 Срспальфа-олефинсульфанаттар
Срспальфа-олефинсульфанаттар Вещества простые и сложные
Вещества простые и сложные Карбонаты. Лекция 12
Карбонаты. Лекция 12 Промышленное получение аминокислот и их применение в медицине и диетологии
Промышленное получение аминокислот и их применение в медицине и диетологии Увлекательный мир химии
Увлекательный мир химии Валентность. Определение валентности по формулам
Валентность. Определение валентности по формулам Основы химической термодинамики
Основы химической термодинамики Теоретические основы метода потенциалов самопроизвольной поляризации - ПС
Теоретические основы метода потенциалов самопроизвольной поляризации - ПС Сера. Физические и химические свойства. Нахождение в природе
Сера. Физические и химические свойства. Нахождение в природе Презентация на тему Правила безопасности труда в кабинете химии
Презентация на тему Правила безопасности труда в кабинете химии  Химия в косметике
Химия в косметике Степень окисления веществ
Степень окисления веществ Алкины
Алкины Как работают наночастицы серебра и меди. Вся продукция AgBionika
Как работают наночастицы серебра и меди. Вся продукция AgBionika