Содержание
- 2. Р-р KCl Твердый KCl Кристаллы сахара Карбонат кальция Вещества разделите на два столбика – электролиты и
- 3. K+; H+; CO32-; Пользуясь таблицей растворимости, определите какие вещества, могут образовывать перечисленные ионы:
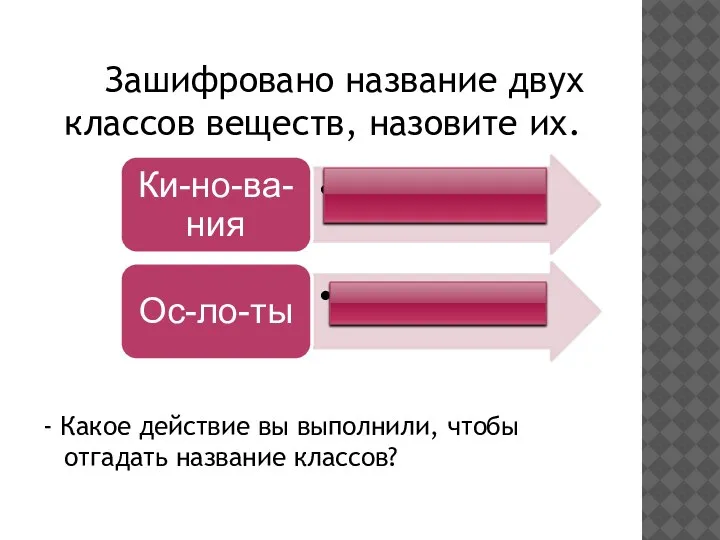
- 4. Зашифровано название двух классов веществ, назовите их. - Какое действие вы выполнили, чтобы отгадать название классов?
- 5. ИОННЫЕ УРАВНЕНИЯ
- 6. Ионные р-ции – р-ции между ионами Ионные ур-я – уравнения ионных р-ций РИО (реакции ионного обмена)
- 7. Правила: В-ва малораств., нераств., газообразных в-в записывают в молекулярном виде. В-во, выпавшее в осадок обозначают -
- 8. Пример: Взаимодействие хлорида бария с сульфатом натрия. BaCl2 + Na2SO4 ? BaSO4 + NaCl Ba2+ 2Cl-
- 9. Условия протекания реакций ионного обмена. I. Если образуется осадок. BaCl2 + Na2SO4 ? BaSO4 + NaCl
- 10. ПРОДОЛЖИТЕ ФРАЗУ: «Сегодня я узнал о ….» «Самым сложным для меня сегодня было…..» «За урок я
- 12. Скачать презентацию








 Презентация на тему Химическое равновесие
Презентация на тему Химическое равновесие  Презентация на тему Неорганические соединения. Периодическая таблица Д.И.Менделеева
Презентация на тему Неорганические соединения. Периодическая таблица Д.И.Менделеева  Сұрақтар
Сұрақтар Теория электролитической диссоциации. Ионные уравнения. Задания
Теория электролитической диссоциации. Ионные уравнения. Задания Органическая химия
Органическая химия Знаки химических элементов
Знаки химических элементов Подготовка к ЕГЭ по химии
Подготовка к ЕГЭ по химии Строение электронных оболочек атомов
Строение электронных оболочек атомов Презентация на тему Интересные факты из жизни Д. И. Менделеева
Презентация на тему Интересные факты из жизни Д. И. Менделеева  Спирты. Строение
Спирты. Строение Электрический ток в металлах
Электрический ток в металлах Галогены. Положение галогенов в ПСХЭ
Галогены. Положение галогенов в ПСХЭ Коррозия металлов. Электрохимическая коррозия
Коррозия металлов. Электрохимическая коррозия Общие представления об электрохимических технологиях
Общие представления об электрохимических технологиях Типы химических реакций. Класс оксиды
Типы химических реакций. Класс оксиды Основные понятия химии
Основные понятия химии Опыты с водой
Опыты с водой Алканы. Физические свойствава алканов
Алканы. Физические свойствава алканов Магний и его сплавы
Магний и его сплавы Валентность химических элементов
Валентность химических элементов Чистячі засоби для ванної кімнати та кафелю
Чистячі засоби для ванної кімнати та кафелю Презентация на тему Строение атомного ядра
Презентация на тему Строение атомного ядра  Атомның электрондық құрылысы
Атомның электрондық құрылысы Химия в моей специальности
Химия в моей специальности Химическая кинетика. Основные понятия. Основы формальной кинетики
Химическая кинетика. Основные понятия. Основы формальной кинетики Презентация на тему Реакции соединения (8 класс)
Презентация на тему Реакции соединения (8 класс)  Glin
Glin Классификация силикатов
Классификация силикатов