Содержание
- 2. Цель работы: установление кинетических закономерностей анодного поведения Mn5Si3-электрода в сернокислом бесфторидном и фторидсодержащем электролитах, выяснение механизмов
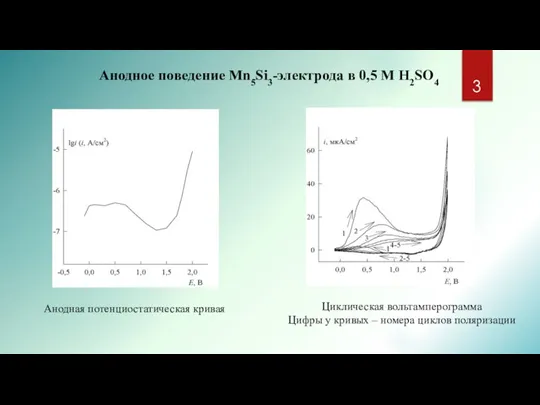
- 3. Анодная потенциостатическая кривая Анодное поведение Mn5Si3-электрода в 0,5 M H2SO4 Циклическая вольтамперограмма Цифры у кривых –
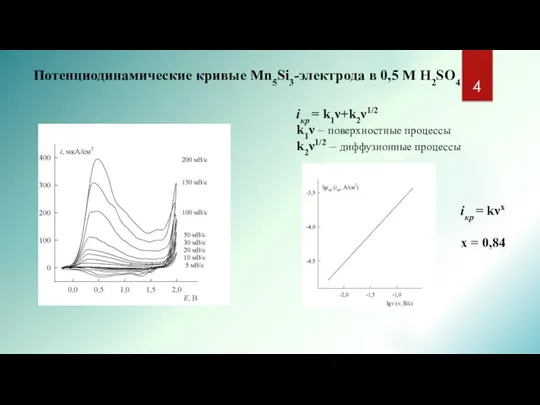
- 4. Потенциодинамические кривые Mn5Si3-электрода в 0,5 M H2SO4 iкp = k1ν+k2ν1/2 k1ν – поверхностные процессы k2ν1/2 –
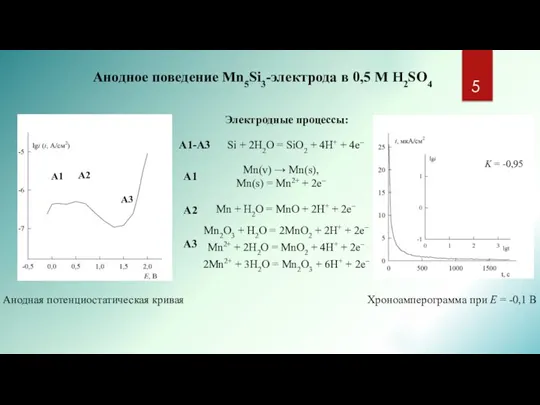
- 5. А1-А3 Si + 2H2O = SiO2 + 4H+ + 4e– Mn2O3 + H2O = 2MnO2 +
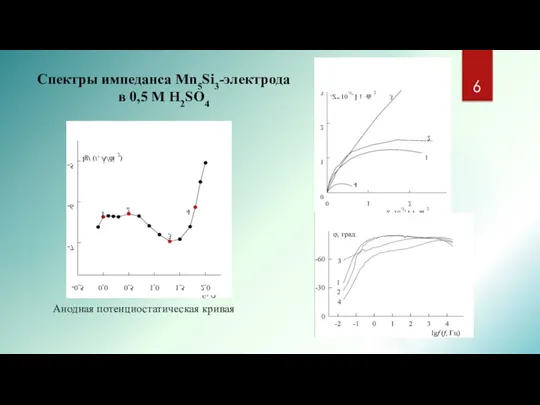
- 6. Анодная потенциостатическая кривая Спектры импеданса Mn5Si3-электрода в 0,5 М Н2SO4
- 7. Зависимость толщины оксидной пленки на Mn5Si3-электроде от потенциала K1 = 0,68 нм/В K2 = 0,37 нм/В
- 8. Анодное поведение Mn5Si3-электрода в 0,5 M H2SO4 + xNaF Анодные потенциостатические кривые Mn5Si3-электрода в 0,5 M
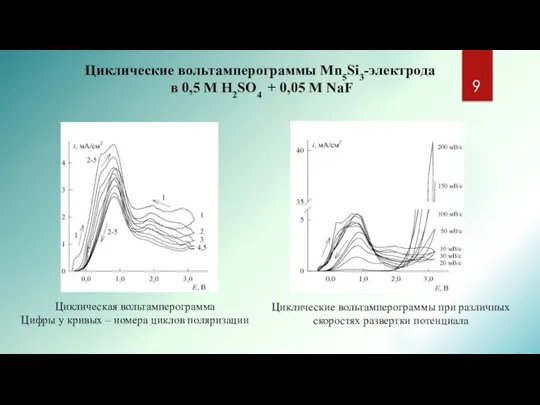
- 9. Циклические вольтамперограммы Mn5Si3-электрода в 0,5 M H2SO4 + 0,05 M NaF Циклическая вольтамперограмма Цифры у кривых
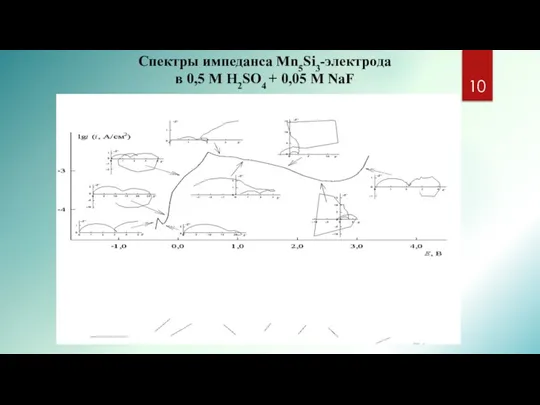
- 10. Спектры импеданса Mn5Si3-электрода в 0,5 М Н2SO4 + 0,05 M NaF
- 11. Спектры импеданса Mn5Si3-электрода в 0,5 М Н2SO4 + 0,05 M NaF
- 12. Анодное поведение Mn5Si3-электрода в 0,5 M H2SO4 + xNaF А1 А2 А3 А4 Электродные процессы: Mn
- 13. Микрофотографии поверхности Mn5Si3-электрода в области пассивации (×700) Исходный образец Анодное травление 0,5 М H2SO4 0,5 М
- 14. Выводы: 1. Анодное поведение силицида марганца (Mn5Si3) в растворе серной кислоты в области потенциалов от E
- 16. Скачать презентацию







 10_KhimiaKlassifikatsia_organicheskikh_soedieniy (1)
10_KhimiaKlassifikatsia_organicheskikh_soedieniy (1) Номенклатура алкенов. Теория
Номенклатура алкенов. Теория Правила работы и хранения щелочных металлов. Утилизация остатков щелочных металлов
Правила работы и хранения щелочных металлов. Утилизация остатков щелочных металлов Изомерия и ее виды
Изомерия и ее виды Количественный анализ
Количественный анализ Прибор “октис-2”
Прибор “октис-2” Электролитическая диссоциация кислот
Электролитическая диссоциация кислот Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Арены – ароматические углеводороды
Арены – ароматические углеводороды Анилин. Строение и свойства анилина
Анилин. Строение и свойства анилина Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул Алкены. Строение, номенклатура, изомерия, физические свойства
Алкены. Строение, номенклатура, изомерия, физические свойства Простые вещества – металлы. Физические свойства металлов. Сплавы
Простые вещества – металлы. Физические свойства металлов. Сплавы Эффект растворителя при определении пространственной структуры сложных гетероциклических соединений
Эффект растворителя при определении пространственной структуры сложных гетероциклических соединений Химия Солнца
Химия Солнца 01_Osnovnye_ponyatia_i_zakony_khimii
01_Osnovnye_ponyatia_i_zakony_khimii Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов
Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов Аллотропия
Аллотропия Презентация на тему Синтетические материалы
Презентация на тему Синтетические материалы  Хроматография. Особенности метода хроматографии
Хроматография. Особенности метода хроматографии Карбоновые кислоты
Карбоновые кислоты Нефть и основные продукты её переработки
Нефть и основные продукты её переработки Жиры. Классификация
Жиры. Классификация Презентация по Химии "Получение уксусной кислоты и опыты с ней"
Презентация по Химии "Получение уксусной кислоты и опыты с ней"  Натуральный каучук
Натуральный каучук Аммиак. Состав вещества
Аммиак. Состав вещества Сложные эфиры. Жиры
Сложные эфиры. Жиры Изомерия органических соединений. Лекция 2
Изомерия органических соединений. Лекция 2