Содержание
- 2. Это вещество было описано арабским химиком в VIII веке Джабиром ибн Хайяном (Гебер) в его труде
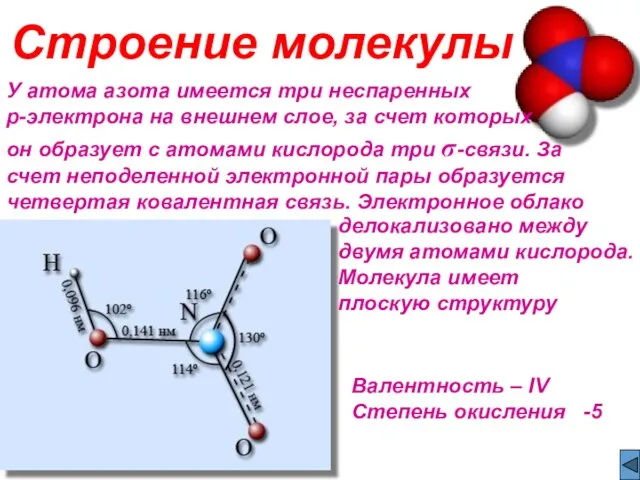
- 3. У атома азота имеется три неспаренных p-электрона на внешнем слое, за счет которых он образует с
- 4. Физические свойства Бесцветная жидкость, дымящая на воздухе. Едкий запах. Желтый цвет концентрированной кислоты (разложение с образованием
- 6. Химические свойства Разбавленная азотная кислота проявляет свойства, общие для всех кислот: Диссоциация в водном растворе: HNO3
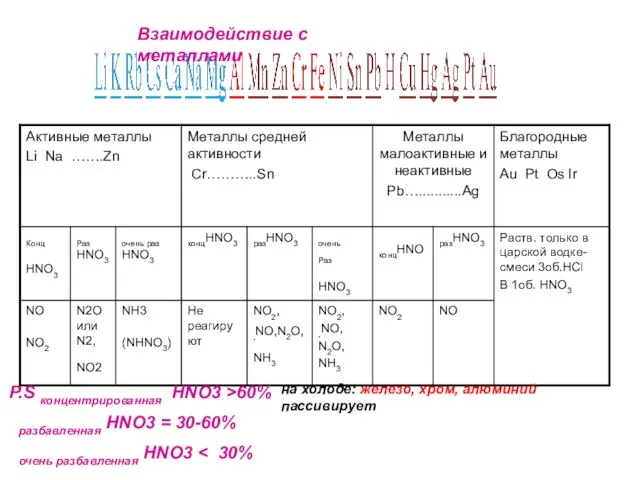
- 7. Специфические свойства – взаимодействие с металлами ЗАПОМНИ! При взаимодействии азотной кислоты любой концентрации с металлами водород
- 8. Окисление металлов: Продукты восстановления зависят от активности металла и разбавленности азотной кислоты (чем активнее металл и
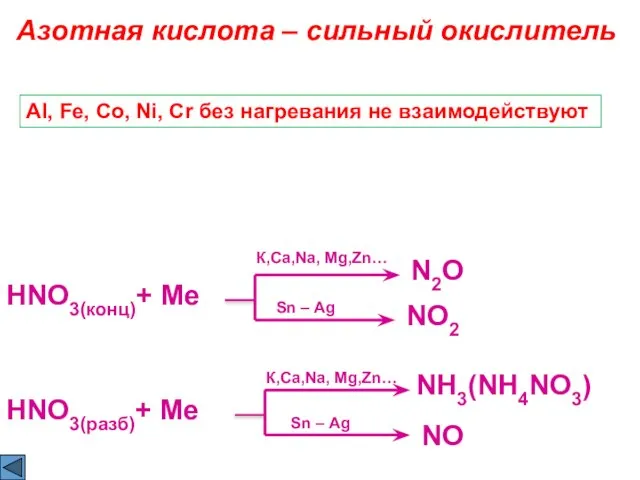
- 9. HNO3(конц)+ Ме Азотная кислота – сильный окислитель N2O Sn – Ag NO2 Al, Fe, Co, Ni,
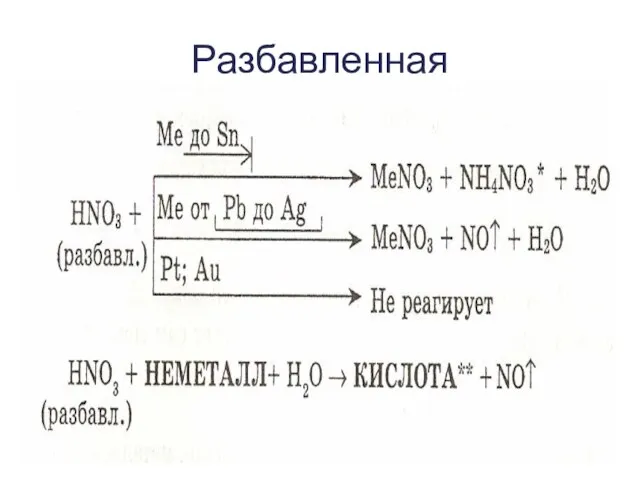
- 10. Разбавленная
- 11. Концентрированная
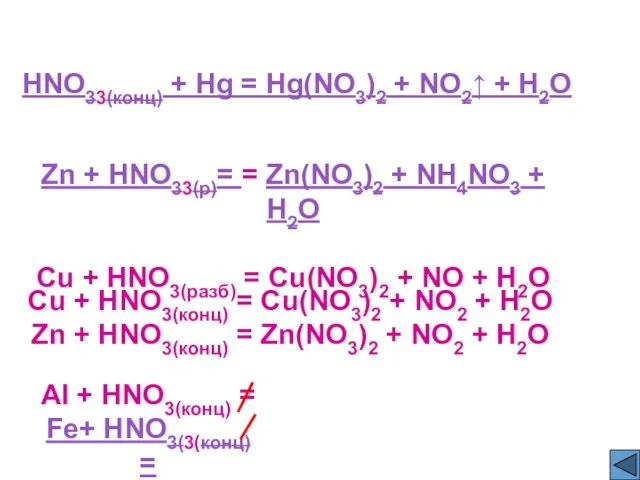
- 12. HNO33(конц) + Hg = Hg(NO3)2 + NO2↑ + H2O Zn + HNO33(р)= = Zn(NO3)2 + NH4NO3
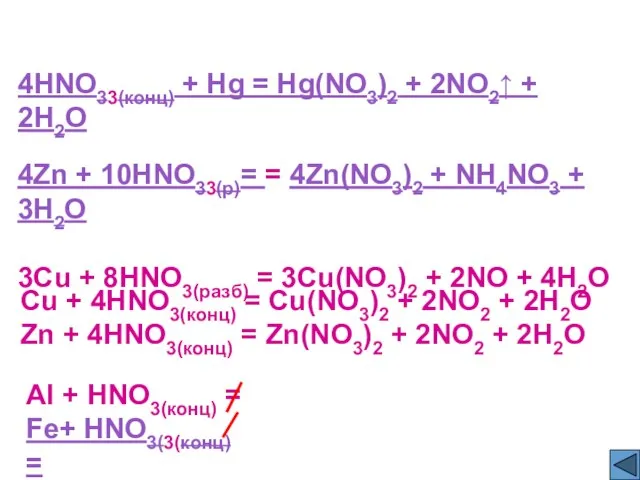
- 13. 4HNO33(конц) + Hg = Hg(NO3)2 + 2NO2↑ + 2H2O 4Zn + 10HNO33(р)= = 4Zn(NO3)2 + NH4NO3
- 14. Взаимодействие с неметаллами При взаимодействии с неметаллами образуется кислота, в которой у неметалла высшая степень окисления,
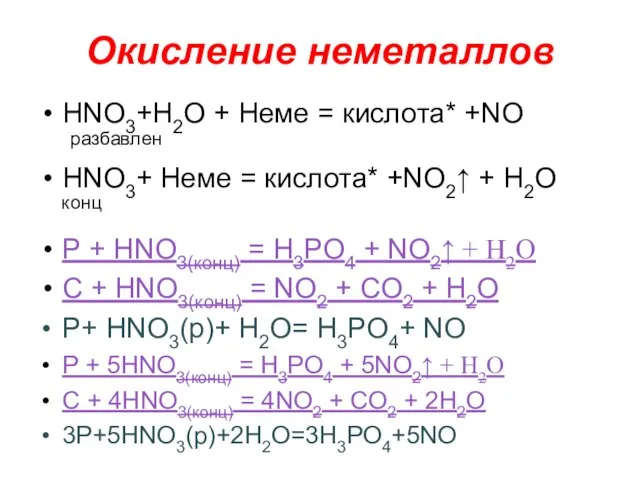
- 15. Окисление неметаллов НNO3+H2O + Неме = кислота* +NO разбавлен НNO3+ Неме = кислота* +NO2↑ + H2O
- 16. Органические вещества окисляются и воспламеняются в азотной кислоте. Белки при взаимодействии с конц. азотной кислотой разрушаются
- 17. Смесь концентрированных азотной и соляной кислот (соотношение по объему 1 :3) называется царской водкой; она растворяет
- 18. Получение азотной кислоты Окисления аммиaка в NO в присутствии платино-родиевого катализатора: 4NH3 + 5O2 = 4NO
- 19. Получение азотной кислоты – взаимодействием калиевой или натриевой селитры с концентрированной серной кислотой при нагревании: KNO3
- 20. Нитраты – соли азотной кислоты (cелитры) Получаются при взаимодействии азотной кислоты с металлами, оксидами металлов, основаниями,
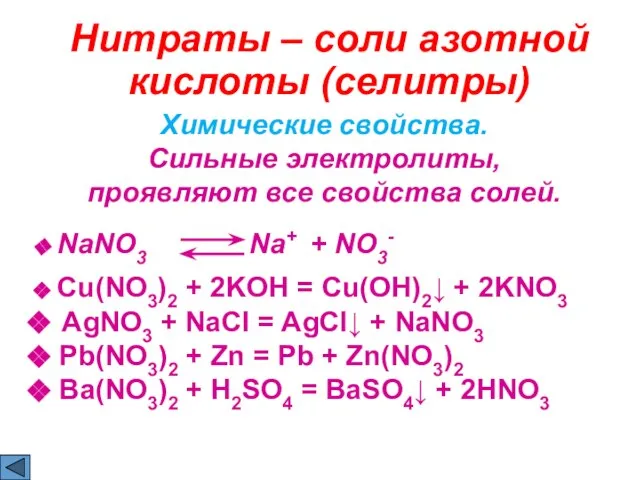
- 21. Нитраты – соли азотной кислоты (cелитры) Химические свойства. Сильные электролиты, проявляют все свойства солей. NaNO3 Na+
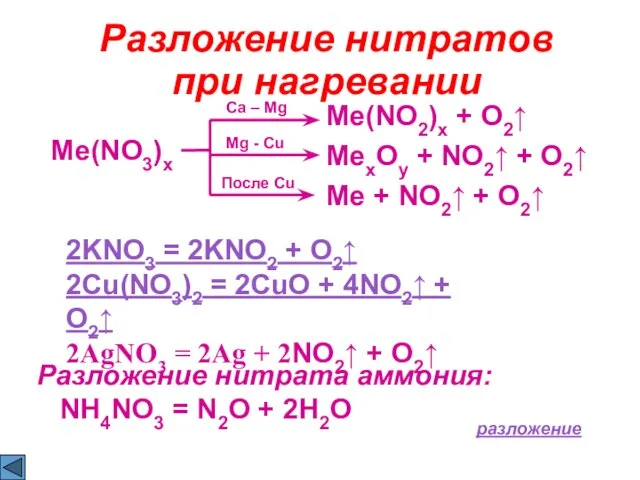
- 22. Разложение нитратов при нагревании Me(NO3)x Ca – Mg Me(NO2)x + O2↑ Mg - Cu MexOy +
- 23. Качественные реакции на азотную кислоту и ее соли NaNO3 + H2SO4 = NaHSO4 + HNO3 4HNO3
- 24. красители лекарства удобрения пластмасса пиротехника взрывчатые вещества Применение азотной кислоты и нитратов HNO3 и нитраты травление
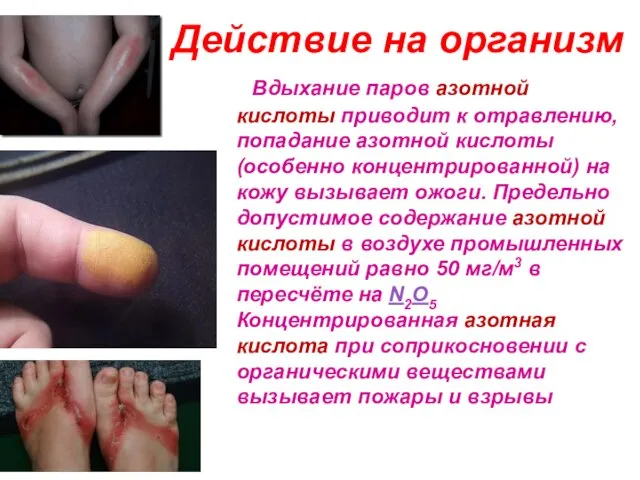
- 25. Действие на организм Вдыхание паров азотной кислоты приводит к отравлению, попадание азотной кислоты (особенно концентрированной) на
- 26. Исследования (задания по группам): (Повторение ПТБ!). 1 группа: провести реакцию раствора азотной кислоты и оксида меди
- 27. Группа №1 CuO + 2 HNO3 = Cu(NO3)2 + H2O - реакция ионного обмена, необратимая CuO
- 28. P.S концентрированная HNO3 >60% разбавленная HNO3 = 30-60% очень разбавленная HNO3 на холоде: железо, хром, алюминий
- 29. Проверь себя: Степень окисления азота в HNO3 а)-3 б)0 в)+5 г)+4 При хранении на свету HNO3
- 30. 1 - в 2 - б 3 - а 4 - а 5 - б ключ
- 31. вывод: 1. Азотной кислоте характерны общие свойства кислот: реакция на индикатор, взаимодействие с оксидами металлов, гидроксидами,
- 33. Скачать презентацию



















 Алкадиены. Физические свойства
Алкадиены. Физические свойства Способы разделения смесей. Урок в 8 классе
Способы разделения смесей. Урок в 8 классе Применение муравьиного спирта
Применение муравьиного спирта Алкены. Строение
Алкены. Строение Халькогены. Электронное строение кислорода и серы
Халькогены. Электронное строение кислорода и серы Наполнители для пластмасс
Наполнители для пластмасс Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс
Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс Электролитическая диссоциация
Электролитическая диссоциация Презентация на тему Природные источники углеводородов
Презентация на тему Природные источники углеводородов  Металлы в организме человека
Металлы в организме человека Основания. Структурная формула
Основания. Структурная формула Угольная кислота и ее соли
Угольная кислота и ее соли Органическая химия. Ароматические углеводороды
Органическая химия. Ароматические углеводороды Инертные газы и перспективы их применения
Инертные газы и перспективы их применения Способы защиты химического оборудования от коррозии
Способы защиты химического оборудования от коррозии Teksta uzdevumi (1)
Teksta uzdevumi (1) Мышьяк. История. Нахождение в природе
Мышьяк. История. Нахождение в природе Гидрофобная хроматография белков
Гидрофобная хроматография белков агрегатные состояния вещества 7 класс
агрегатные состояния вещества 7 класс Классификация химических реакций по различным основаниям
Классификация химических реакций по различным основаниям Презентация на тему Полимеры
Презентация на тему Полимеры  АРЕНЫ
АРЕНЫ Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Углеводороды
Углеводороды Минерал гранат
Минерал гранат Классификация химических реакций
Классификация химических реакций Хімічна промисловість
Хімічна промисловість Неорганические основания
Неорганические основания