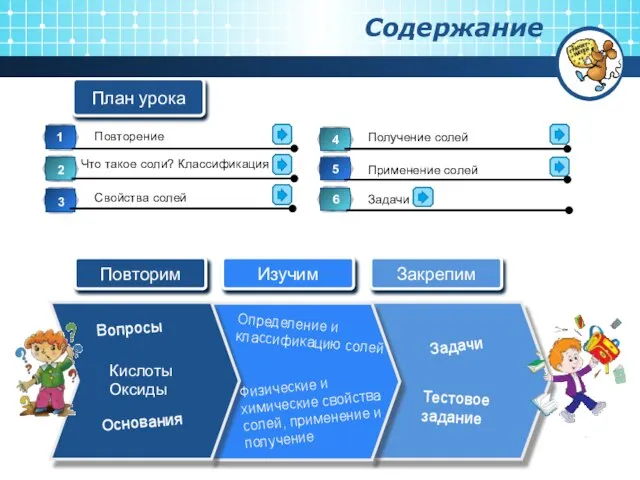
Содержание
- 2. Вопросы Кислоты Оксиды Физические и химические свойства солей, применение и получение Основания Определение и классификацию солей
- 3. Соли – сложные вещества, образованные атомами металлов и кислотного остатка Что такое соли? Классификация солей Na3PO4
- 4. Свойства солей Физические свойства Соли - твердые вещества разного цвета. Растворимость их различна. Некоторые хорошо растворимы,
- 5. Химические свойства Соли реагируют с металлами ( исключения активные металлы: Li, Na, K, Ca, Ba -
- 6. Соли реагируют с некоторыми кислотными оксидами: CaCO3 + SiO2 = CaSiO3 + CO2 Соли реагируют с
- 7. Получение солей Взаимодействие металлов и неметаллов: 2Fe + 3Cl2 = 2FeCl3 Взаимодействие кислотных оксидов с основными
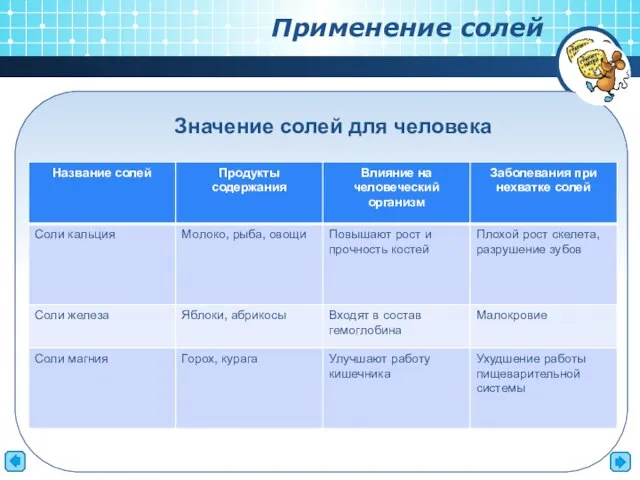
- 8. Применение солей Значение солей для человека
- 9. m =m = 18,8 гm = 18,8 г nm = 18,8 г n m = 18,8
- 10. Дано: Решение: n (CuO) = 0,1 моль CuO + 2HNO3 = Cu(NO3)2 + H2O HNO3 n
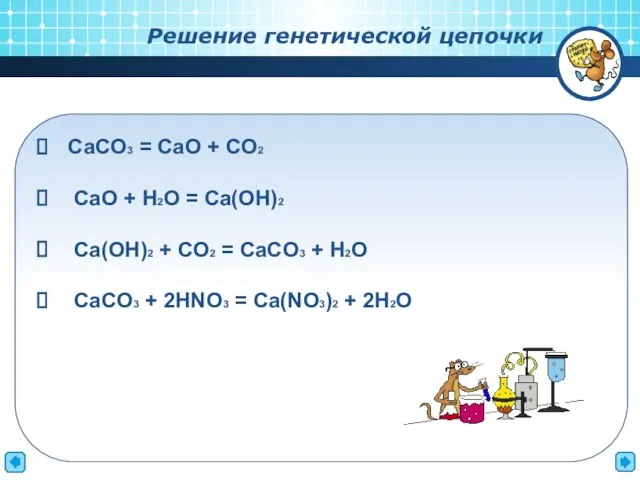
- 11. СaCO3 = CaO + CO2 CaO + H2O = Ca(OH)2 Ca(OH)2 + CO2 = CaCO3 +
- 13. Скачать презентацию







 Гидролиз солей
Гидролиз солей Химический анализ. Исследовательская деятельность (8 класс)
Химический анализ. Исследовательская деятельность (8 класс) Свободные атомы. Простые вещества. Сложные вещества
Свободные атомы. Простые вещества. Сложные вещества Алканы
Алканы Теория электролитической диссоциации
Теория электролитической диссоциации Номенклатура алканов разветвленного строения
Номенклатура алканов разветвленного строения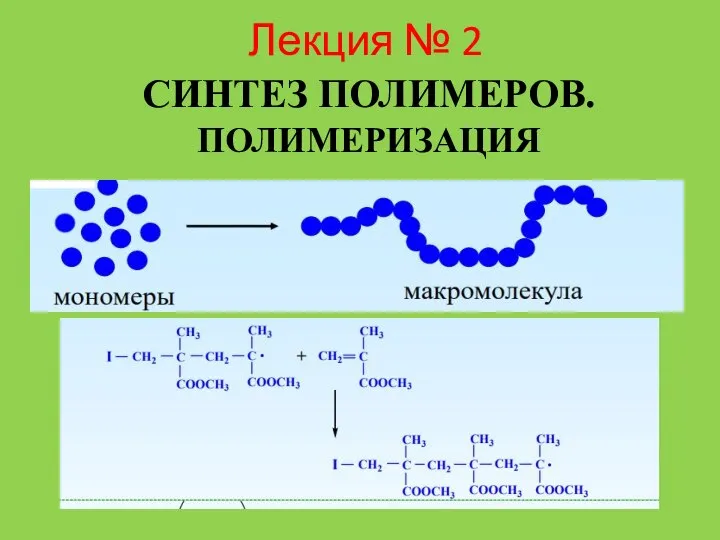 Лекция № 2. Синтез полимеров. Полимеризация
Лекция № 2. Синтез полимеров. Полимеризация Гранулометричний склад матеріалу і його характеристики
Гранулометричний склад матеріалу і його характеристики Оксиды и их свойства
Оксиды и их свойства Германий, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение
Германий, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение Тоқырау аймағы бар аппараттың математикалық моделі
Тоқырау аймағы бар аппараттың математикалық моделі Щелочные металлы
Щелочные металлы Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение
Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение Теория электролитической диссоциации
Теория электролитической диссоциации Пероксид водорода
Пероксид водорода Пример выполнения проверочной работы по теме углеводороды
Пример выполнения проверочной работы по теме углеводороды 11. Дисперсные системы
11. Дисперсные системы Конструкционные и функциональные материалы: конструкционные материалы. Введение
Конструкционные и функциональные материалы: конструкционные материалы. Введение Занимательная химия Программу составил
Занимательная химия Программу составил  Витамины. (10 класс)
Витамины. (10 класс) Ресурс Лови оксиды для систематизации знаний, умений, навыков по теме Оксиды
Ресурс Лови оксиды для систематизации знаний, умений, навыков по теме Оксиды Серная кислота
Серная кислота Классификация химических реакций
Классификация химических реакций Белки
Белки Решение задач на определение массовой (объемной) доли выхода продукта реакции от теоретически возможного
Решение задач на определение массовой (объемной) доли выхода продукта реакции от теоретически возможного Химическая связь в твердых телах. Экзаменационные вопросы
Химическая связь в твердых телах. Экзаменационные вопросы Электрические явления на поверхности раздела фаз. Лекция 8
Электрические явления на поверхности раздела фаз. Лекция 8 Обобщение. Неметаллы
Обобщение. Неметаллы