Содержание
- 2. Первая гипотеза строения атома предложена английским учёным Томсоном(1904)-статическая или электронно-ионная теория
- 3. Для проверки гипотезы Томсона Резерфорд (1911) провёл серию опытов по рассеиванию альфа -частиц тонкими металлическими пластинами.
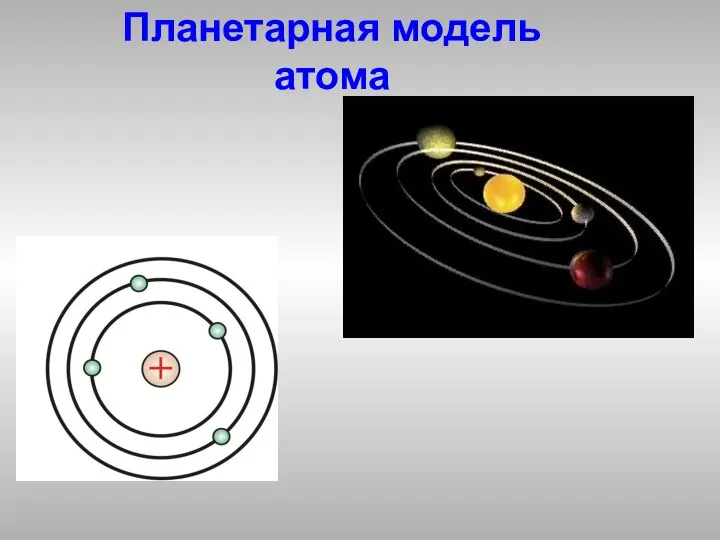
- 4. Планетарная модель атома
- 6. Zn0 имеет 30 протонов = № п-п Аr (Zn) – число протонов= число нейтронов 65 -30
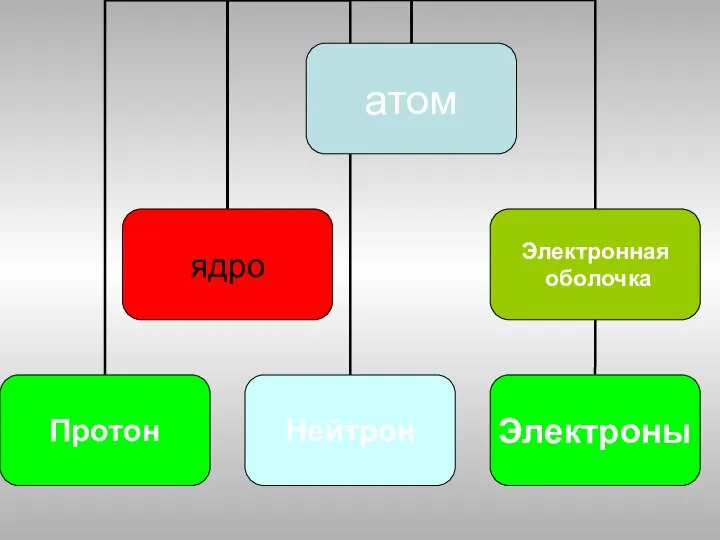
- 7. Э Z А А- атомное число – относительная атомная масса Z-зарядное число- заряд ядра атома
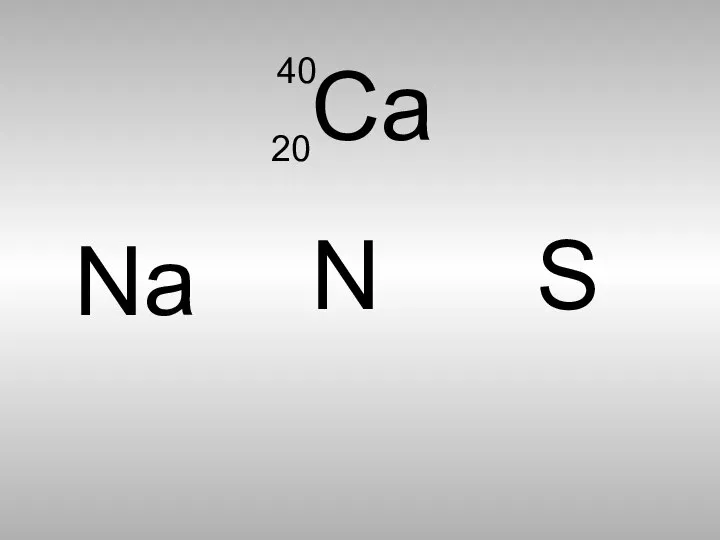
- 8. Са 40 20 Nа S N
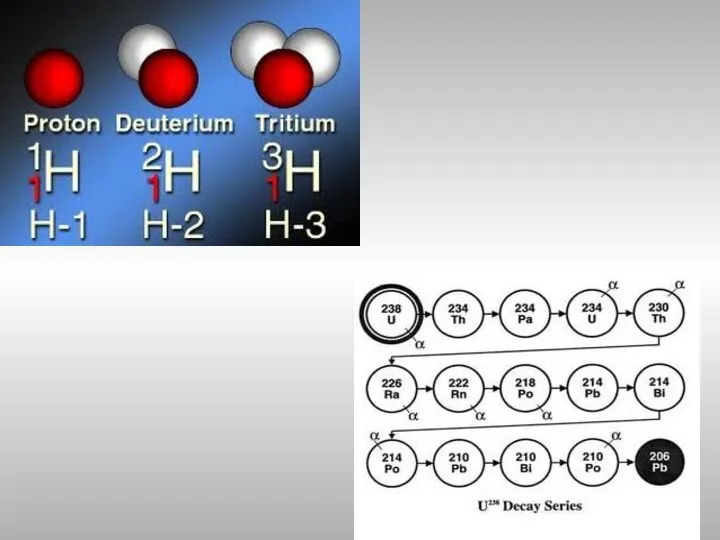
- 9. Изотопы Изотопы − атомы с одинаковыми значениями Z, но различными А то есть разное число нейтронов
- 11. Изоэлектрические частицы. Na 0 -11 электронов Na +1- 10 электронов S 0 -16 электронов S +4-
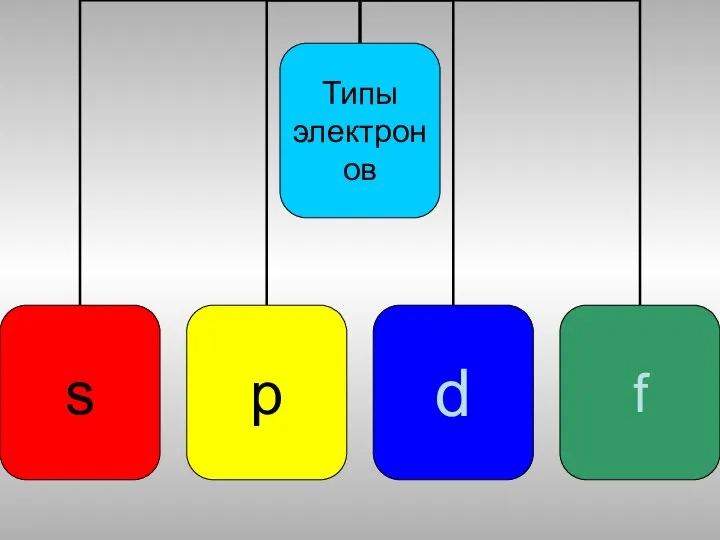
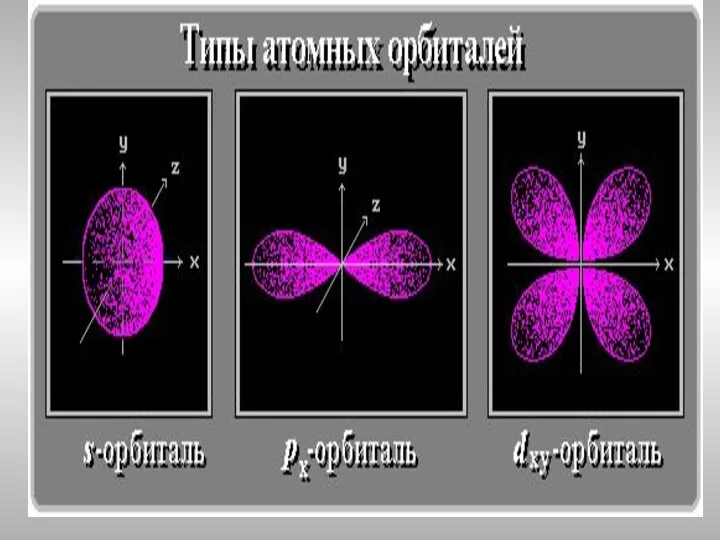
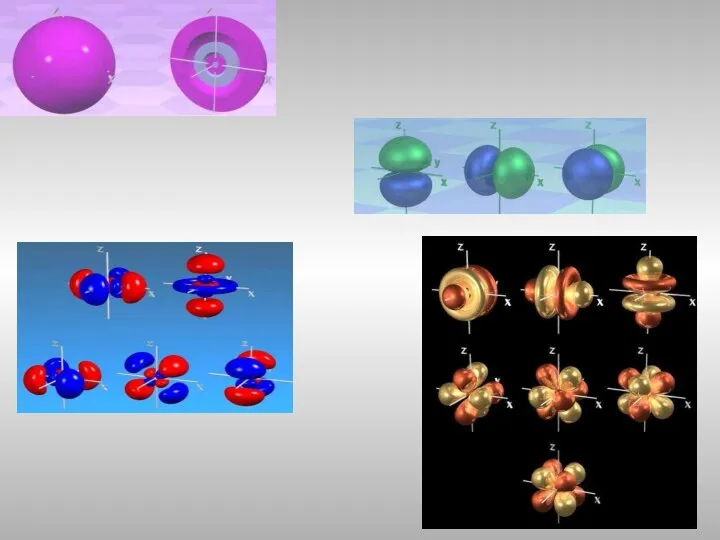
- 15. Распределение электронных подуровней
- 16. Электронная формула 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 4f 5d 5f……7f
- 17. Валентные электроны S - 1s2 2s2 2p 6 3s 3p 2 4 Se - 1s2 2s2
- 18. Точный "адрес" электрона в оболочке определяется с помощью квантовых чисел. n- главное квантового числа принимать только
- 19. ℓ-орбитальное квантовое число, номер для подуровня ℓ-изменяется от 0 до n-1 ℓ= 0 – это s-подуровень,
- 20. Магнитное квантовое число ml определяет ориентацию электронного облака в пространстве, связано с ℓ и может принимать
- 21. Спиновое квантовое число ms характеризует собственное вращение электрона вокруг своей оси. Может принимать значения +½ и
- 22. Принцип Паули или запрета : Никакие два электрона в одном атоме не могут характеризоваться одинаковым набором
- 23. Правило Хунда (Гунда) – суммарное значение спиновогоспинового квантового числаспинового квантового числа электронов -должно быть максимальным.
- 25. Скачать презентацию















 Застосування рідких кристалів
Застосування рідких кристалів Каталітичні процеси нафтопереробки
Каталітичні процеси нафтопереробки Классификация органических соединений
Классификация органических соединений Топливо и расчеты его горения
Топливо и расчеты его горения Биогаз. Технология производства
Биогаз. Технология производства Простые вещества – неметаллы. Получение и химические свойства неметаллов
Простые вещества – неметаллы. Получение и химические свойства неметаллов Характеристика элемента по положению в таблице Д.И.Менделеева
Характеристика элемента по положению в таблице Д.И.Менделеева Классификация органических соединений. Предельные углеводороды (УВ)
Классификация органических соединений. Предельные углеводороды (УВ) Соединения железа
Соединения железа Моющие и чистящие средства
Моющие и чистящие средства Презентация на тему Экологические риски при добыче и переработке нефти
Презентация на тему Экологические риски при добыче и переработке нефти  Составление формул оксидов, оснований, солей
Составление формул оксидов, оснований, солей Металлы 1 А - группы. Щелочные металлы
Металлы 1 А - группы. Щелочные металлы Методы получения нафтиридинов (всех изомеров)
Методы получения нафтиридинов (всех изомеров) Теория химического строения (ТХС). Предпосылки создания
Теория химического строения (ТХС). Предпосылки создания Электролиз
Электролиз Фенолы и их применение
Фенолы и их применение Коррозионно-активное воздействие на РЭС. Оценка коррозионной стойкости. Лекция №11
Коррозионно-активное воздействие на РЭС. Оценка коррозионной стойкости. Лекция №11 Соли. Применение солей
Соли. Применение солей Соли аммония
Соли аммония Арены
Арены 6. Характеристика элементов на основе положения в периодической системе
6. Характеристика элементов на основе положения в периодической системе Применение каучука
Применение каучука Химическая шкатулка
Химическая шкатулка Искусственные и синтетические ткани
Искусственные и синтетические ткани Текстуры руд
Текстуры руд Научно-исследовательская деятельность учащихся в процессе изучения химии
Научно-исследовательская деятельность учащихся в процессе изучения химии Синтез макромолекул
Синтез макромолекул