Содержание
- 3. Атом греч. atomos «неделимый»
- 5. Антуан Анри Беккерель Антуан Анри Беккерель Открывает явление самопроизвольного деления атома, которое было названо радиоактивностью.
- 6. Жан Батист Перрен В 1901 г. физик предложил первую модель строения атома.
- 7. Эрнест Резерфорд В 1911 г. предложил уточнённую «планетарную» модель строения атома.
- 8. Эрнест Резефорд В 1913 г. доказал, что порядковый (атомный) номер химического элемента численно равен заряду ядра
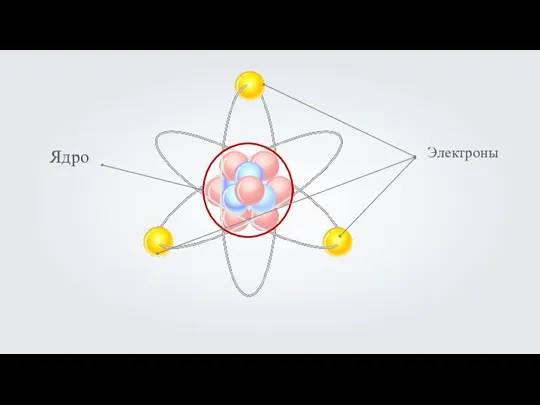
- 9. Атом – наименьшая частица химического элемента, являющаяся носителем его свойств
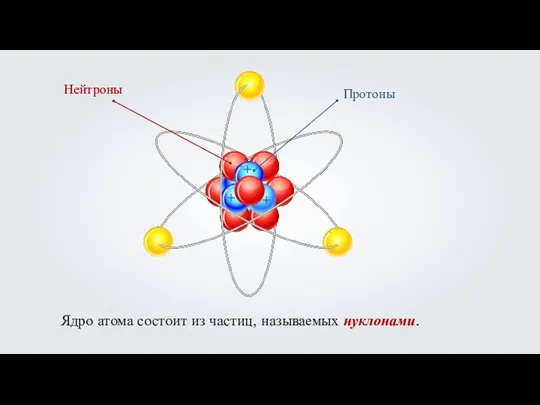
- 11. Ядро атома состоит из частиц, называемых нуклонами. + + +
- 12. Протоны p+
- 13. Нейтроны n0 N = A – Z A ≈ Сумма протонов и нейтронов
- 14. Нейтроны Найдём число нейтронов в ядре калия. N = A – Z A = 39 Z
- 15. Нейтроны Найдём число нейтронов в ядре аргона. N = A – Z A = 40 Z
- 16. Электроны е- Число электронов равно числу протонов.
- 17. Найдем из периодической системы число электронов и протонов брома. Электроны Число электронов = 35 Z =
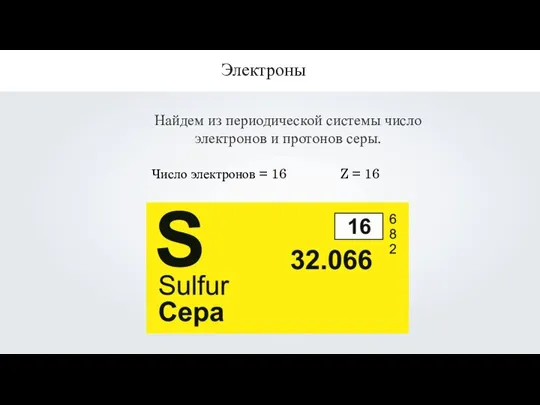
- 18. Найдем из периодической системы число электронов и протонов серы. Электроны Число электронов = 16 Z =
- 19. Найдем из периодической системы число электронов и протонов никеля. Электроны Число электронов = 28 Z =
- 21. Разные атомы одного и того же химического элемента различаются по массам.
- 22. Заряд ядра = +1 (1 электрон + 1 протон)
- 23. Изотопы — разновидности атомов одного и того же химического элемента, имеющие разные массы
- 24. Если число протонов в ядре совпадает с числом электронов, то атом электрически нейтрален. Если же число
- 26. Нанотехнологии
- 28. Скачать презентацию



















 Минеральные кислоты. Взаимодействие с простыми веществами
Минеральные кислоты. Взаимодействие с простыми веществами Легированные стали
Легированные стали Коррозия металлов
Коррозия металлов Простые вещества - неметаллы
Простые вещества - неметаллы Металлы и их соединения
Металлы и их соединения Физический этап развития периодического закона
Физический этап развития периодического закона Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Атом. Ядро и электронная оболочка. Изотопы. Строение электронных оболочек атома. Понятие об орбиталях
Атом. Ядро и электронная оболочка. Изотопы. Строение электронных оболочек атома. Понятие об орбиталях Кислоты. Классификация кислот
Кислоты. Классификация кислот Коррозия металлов и борьба с ней. Лабораторная работа
Коррозия металлов и борьба с ней. Лабораторная работа Агрегатное состояние вещества
Агрегатное состояние вещества Круговорот азота
Круговорот азота Химия – это наука о …
Химия – это наука о … Дисперсные системы
Дисперсные системы Электролитическая диссоциация. 8 класс
Электролитическая диссоциация. 8 класс Презентация на тему Оксиды. Основания. Кислоты
Презентация на тему Оксиды. Основания. Кислоты  Химические элементы
Химические элементы Phosphorus
Phosphorus Азот в сельском хозяйстве
Азот в сельском хозяйстве ЭТА УВЛЕКАТЕЛЬНАЯ ХИМИЯ… Первый урок химии в 8 классе Абрамова С.И., учитель химии МОУ «Лихославльская СОШ №2» Тверской области
ЭТА УВЛЕКАТЕЛЬНАЯ ХИМИЯ… Первый урок химии в 8 классе Абрамова С.И., учитель химии МОУ «Лихославльская СОШ №2» Тверской области Простые вещества - металлы
Простые вещества - металлы Полимеры в медицине
Полимеры в медицине Магматические породы
Магматические породы Обмен и функции нуклеотидов
Обмен и функции нуклеотидов Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс
Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс Основания: определение, классификация, химические свойства
Основания: определение, классификация, химические свойства Натуральные и синтетические каучуки
Натуральные и синтетические каучуки Оксиды азота. Азотная кислота
Оксиды азота. Азотная кислота