Слайд 2Оксиды азота
N2O NO N2O3 NO2 N2O5
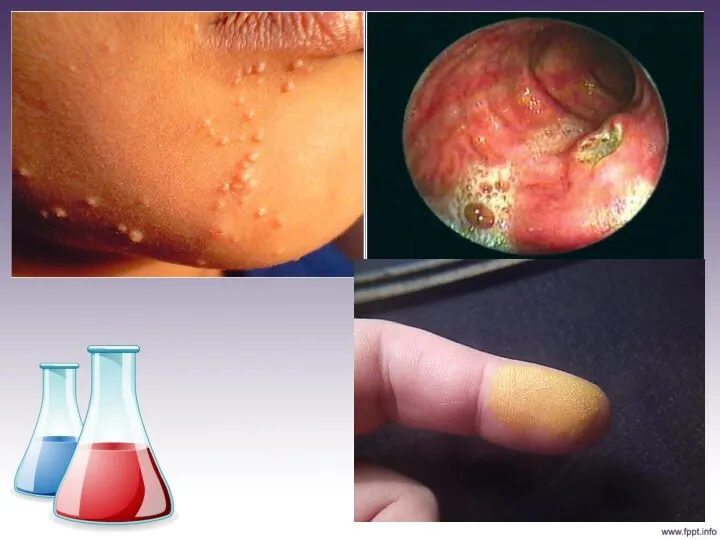
Оксиды азота раздражающе воздействуют на слизистые
оболочки глаз, носа, разрушают легкие человека. Как правило, отравление организма человека NOx проявляется не сразу, а постепенно, причем каких либо нейтрализующих средств нет.
Слайд 4Получение кислот из оксидов азота
N2O3 + H2O = 2HNO2
2NO2 + H2O = HNO2 + HNO3
2NO
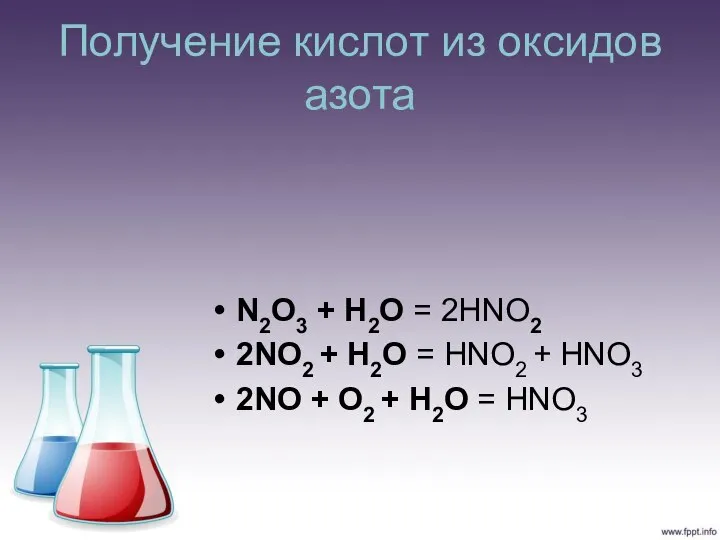
+ O2 + H2O = HNO3
Слайд 5Азотная кислота
Азотная кислота — бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения

+82,6 °C с частичным разложением. Азотная кислота смешивается с водой во всех соотношениях. Водные растворы HNO3 с массовой долей 0,95-0,98 называют «дымящей азотной кислотой», с массовой долей 0,6-0,7 — концентрированной азотной кислотой.
Слайд 6Химические свойства
1. Полная диссоциация в водном растворе (запишите уравнение реакции)
HNO3 ↔ H+ + NO3-
2. Разложение

на оксид азота (IV), кислород и воду
Слайд 7 3. Реакция концентрированной азотной кислоты с металлами
4. Реакция разбавленной азотной кислоты с
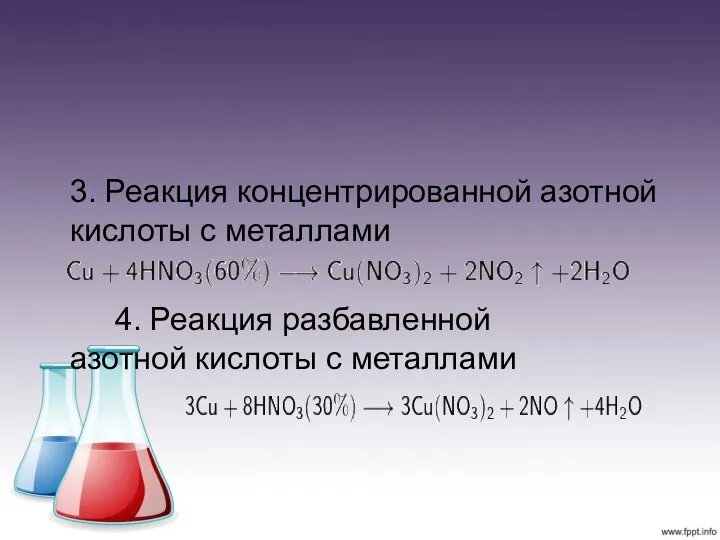
металлами
Слайд 10Самостоятельная работа
1. Причиной возникновения кислотных дождей являются массовые промышленные выбросы диоксида серы

и оксидов азота. Исходя из знаний, полученных на сегодняшнем уроке самостоятельно написать уравнения реакций на листочках.
2. Уравнять методом электронного баланса реакцию разбавленной азотной кислоты с медью.








 Ионные равновесия в растворах
Ионные равновесия в растворах Скорость химической реакции. 9 класс
Скорость химической реакции. 9 класс Презентация на тему Кристаллы
Презентация на тему Кристаллы  Изучение основных породообразующих минералов горных пород. Лабораторная работа №1
Изучение основных породообразующих минералов горных пород. Лабораторная работа №1 Физико-химические методы получения порошков металлов
Физико-химические методы получения порошков металлов Физико - химические основы получения лекарственных препаратов (лекция 4)
Физико - химические основы получения лекарственных препаратов (лекция 4) Сложные эфиры. Жиры
Сложные эфиры. Жиры 12 принципов зелёной химии
12 принципов зелёной химии Кислоты
Кислоты Химические уравнения
Химические уравнения Аммиак
Аммиак Взаимодействие металлов с водой, щелочами, кислотами, солями, простыми веществами
Взаимодействие металлов с водой, щелочами, кислотами, солями, простыми веществами Строение и номенклатура карбонильных соединений
Строение и номенклатура карбонильных соединений Природный газ. 10 класс
Природный газ. 10 класс Опыт тепло и холод. Поглощение тепла и кристаллическая ёлочка
Опыт тепло и холод. Поглощение тепла и кристаллическая ёлочка Вредна ли губная помада
Вредна ли губная помада Массовая доля растворенного вещества
Массовая доля растворенного вещества Гомологи и изомеры
Гомологи и изомеры Презентация на тему Щелочные металлы (9 класс)
Презентация на тему Щелочные металлы (9 класс)  Модельные представления силикатных структур
Модельные представления силикатных структур Альфа- и бета- распад. Правило смещения
Альфа- и бета- распад. Правило смещения каталитический крекинг
каталитический крекинг Презентация на тему Вредное воздействие нитратов на организм человека
Презентация на тему Вредное воздействие нитратов на организм человека  Химическое расследование. Химические свойства галогенов
Химическое расследование. Химические свойства галогенов Основания. Классификация
Основания. Классификация Кварцевые пески
Кварцевые пески Презентация на тему Углекислый газ
Презентация на тему Углекислый газ  Строение и свойства предельных и непредельных углеводородов. . Обобщающий урок по химии 10 класс
Строение и свойства предельных и непредельных углеводородов. . Обобщающий урок по химии 10 класс