Содержание
- 2. Цели урока: Повторить особенности строения атомов металлов и металлическую химическую связь Познакомить с общими физическими свойствами
- 3. содержание Положение металлов в Периодической системе Д.И.Менделеева особенности строения атомов металлов металлическая химическая связь общие физические
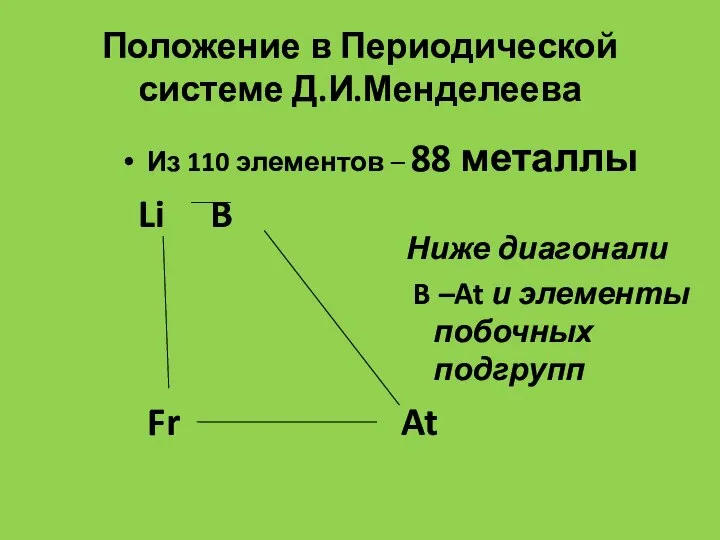
- 4. Положение в Периодической системе Д.И.Менделеева Из 110 элементов – 88 металлы Li B Ниже диагонали B
- 5. Особенности строения атомов металлов 1-3 электрона на внешнем уровне большой радиус атома Ме0 – nе Ме+n
- 6. Металлическая Химическая связь в металлах и сплавах
- 7. Общие физические свойства металлов Твердость Электропроводность Теплопроводность Металлический блеск Ковкость и пластичность Звон Цвет
- 8. 1.Твердость (кроме Hg) Ртуть- жидкий металл Самый твердый - хром Cr (царапает стекло) Мягкие – щелочные
- 9. 2.Электропроводность и теплопроводность Ag Cu Au Al Mg Zn Fe Pb Hg Электропроводность уменьшается Хорошие проводники
- 10. 3.Металлический блеск (способность отражать световую волну) Самый блестящий-Hg Венецианские зеркала Блестящий - Аg Современные зеркала
- 11. 4.Ковкость и пластичность Наиболее пластичные металлы- Au Ag Cu Sn Pb Zn Подсвечники из золота Очень
- 12. 5.Звон (способность отражать звуковую волну) Самые звонкие- Ag Cu Au Царь-колокол
- 13. 6.Цвет Черные – Fe и его сплавы Чугунная решетка Цветные (все остальные) среди них драгоценные Au
- 14. Аллотропия – свойства химического элемента образовывать разные простые вещества (из одного элемента могут образовываться несколько простых
- 15. Аллотропия олова Белое олово b-Sn (металл) Серое олово a-Sn (неметалл)
- 16. Домашнее задание Параграф 13 (читать) Параграф 14 (выучить) Сделать записи в тетрадь (с этой презентации) Выполнить
- 18. Скачать презентацию














 Предельные углеводороды
Предельные углеводороды Решение задач по органической химии
Решение задач по органической химии Получение и применение кислорода. Круговорот кислорода в природе
Получение и применение кислорода. Круговорот кислорода в природе Физические свойства полупроводников
Физические свойства полупроводников Презентация на тему Органическая химия "Жиры"
Презентация на тему Органическая химия "Жиры"  Кислород как вещество
Кислород как вещество Удосконалення процесів знешкодження рідких відходів виробництв оцтової кислоти потужністю 150 тис. т/рік
Удосконалення процесів знешкодження рідких відходів виробництв оцтової кислоти потужністю 150 тис. т/рік Презентация на тему Оксиды. Основания. Кислоты
Презентация на тему Оксиды. Основания. Кислоты  Алкены. Роль алкенов в жизни человека
Алкены. Роль алкенов в жизни человека Соединения галогенов
Соединения галогенов Химический анализ
Химический анализ Влияние эллементов на состав растений. Содержание тяжелого металла в растениях. Нитраты в растениях
Влияние эллементов на состав растений. Содержание тяжелого металла в растениях. Нитраты в растениях Гетероциклические соединения. Пятичленные гетероциклы с одним гетероатомом
Гетероциклические соединения. Пятичленные гетероциклы с одним гетероатомом Аттестационная работа. Сколько наша семья потребляет энергоресурсов и выбрасывает углекислого газа
Аттестационная работа. Сколько наша семья потребляет энергоресурсов и выбрасывает углекислого газа Веселый химический КВН
Веселый химический КВН Синтез ацетилена из природного газа в производстве ацетилена
Синтез ацетилена из природного газа в производстве ацетилена Соединения щелочноземельных металлов
Соединения щелочноземельных металлов Кислород. Применение и круговорот в природе. 8 класс
Кислород. Применение и круговорот в природе. 8 класс Презентация по Химии "Токсическое действие неорганических веществ"
Презентация по Химии "Токсическое действие неорганических веществ"  Химия углеводов
Химия углеводов Строение атома
Строение атома Вода. Строение молекулы воды. Анализ и синтез воды
Вода. Строение молекулы воды. Анализ и синтез воды Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Практико-ориентированные задачи по химии для студентов гуманитарных специальностей
Практико-ориентированные задачи по химии для студентов гуманитарных специальностей Коррозия металлов (9 класс)
Коррозия металлов (9 класс) Углеводы. Классификация
Углеводы. Классификация Фторопласты и их использование
Фторопласты и их использование lektsia_7
lektsia_7