Содержание
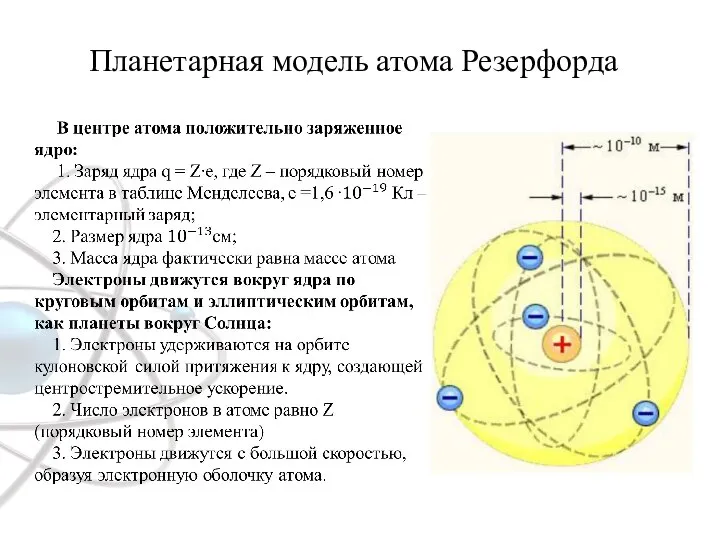
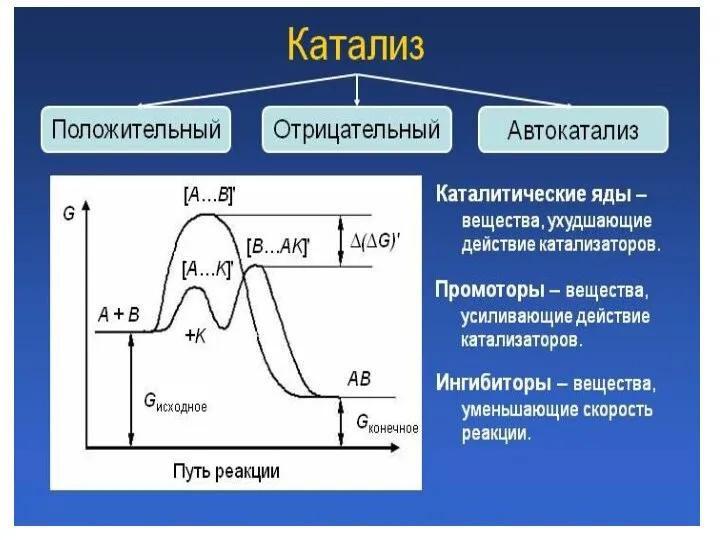
- 2. Планетарная модель атома Резерфорда
- 3. 1) В атоме существуют орбиты, двигаясь по которым, электрон не излучает. Они называются стационарными. 2) Излучение
- 4. Луи Де Бройль В 1924 году французский физик Луи Де Бройль высказал гипотезу о том, что
- 5. Принцип неопределённости Гейзенберга Чем точнее мы знаем координаты частицы, тем менее точно мы можем определить ее
- 6. Электрон в атоме является стоячей волной (его состояние не зависит от времени). Он представляет собой облако
- 7. Квантовые числа n – главное квантовое число; оно определяет размеры электронного облака и энергию электрона n
- 8. Состояние электрона в многоэлектронном атоме Чем больше n, тем больше энергия электрона (больше размер электронного облака,
- 9. Принцип наименьшей энергии Атом стремится к минимуму энергии. Электроны заполняют АО с увеличением энергии (с увеличением
- 10. Принцип Паули (принцип запрета) В атоме не может быть двух электронов с одинаковым набором четырёх квантовых
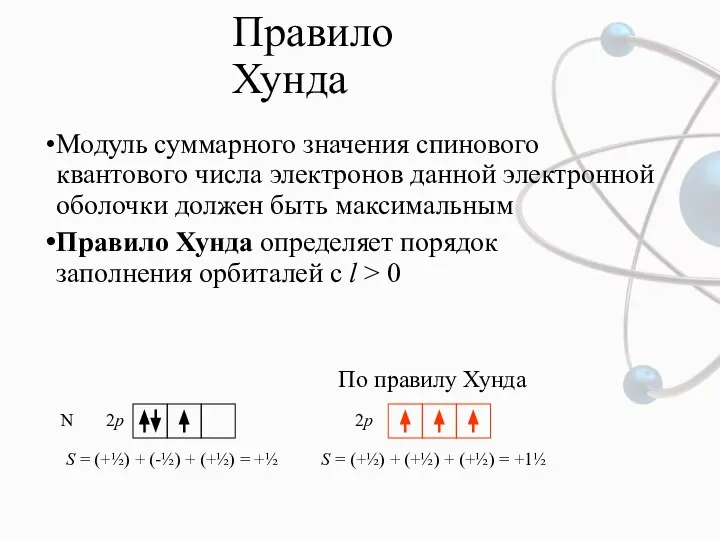
- 11. Правило Хунда Модуль суммарного значения спинового квантового числа электронов данной электронной оболочки должен быть максимальным Правило
- 12. Правила заполнения энергетических уровней Правило Клечковского (1961 г.): Меньшей энергии электрона отвечает состояние, которое характеризуется меньшей
- 13. Типы химической связи Ковалентная: неполярная (образуется между атомами с одинаковой электроотрицательностью); полярная (образуется между атомами с
- 14. Основные положения метода ВС 1. Ковалентная связь образуют два электрона с противоположным спинами, принадлежащие двум атомам
- 16. Энтальпия – функция состояния ΔH = H2 – H1 = U2 + pV2 – U1 –
- 17. Экзо- и эндотермические процессы Эндотермический процесс ΔH = H2 – H1 > 0 H2 > H1
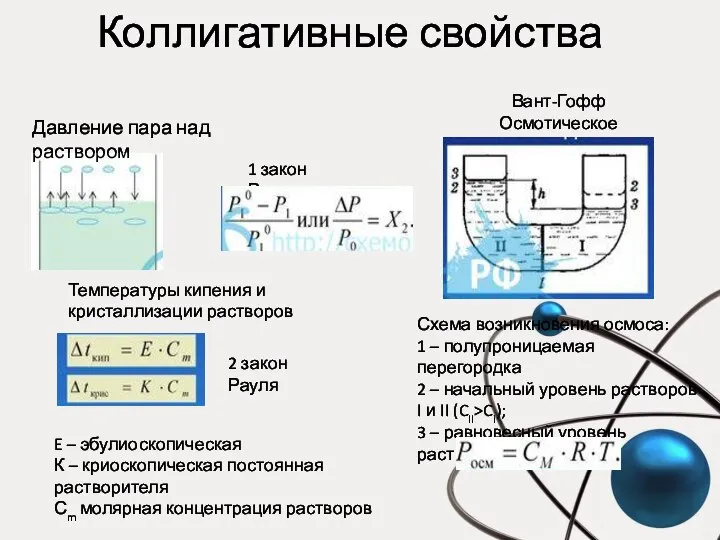
- 30. Коллигативные свойства Давление пара над раствором Вант-Гофф Осмотическое давление 1 закон Рауля: Температуры кипения и кристаллизации
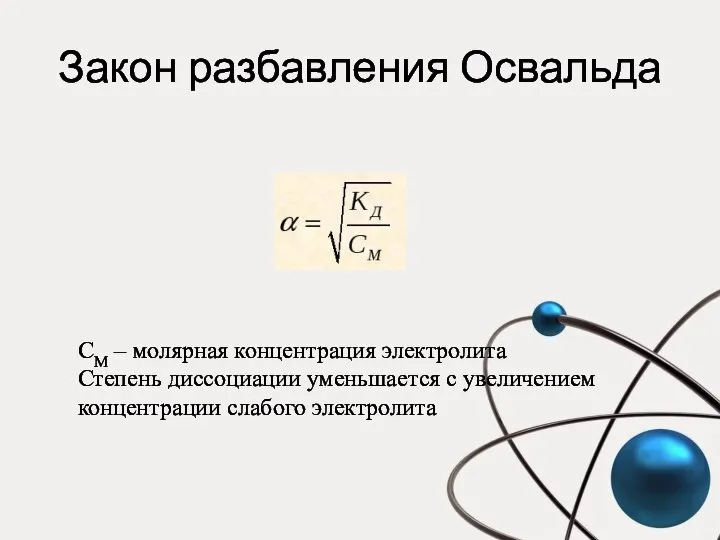
- 32. Закон разбавления Освальда СM – молярная концентрация электролита Степень диссоциации уменьшается с увеличением концентрации слабого электролита
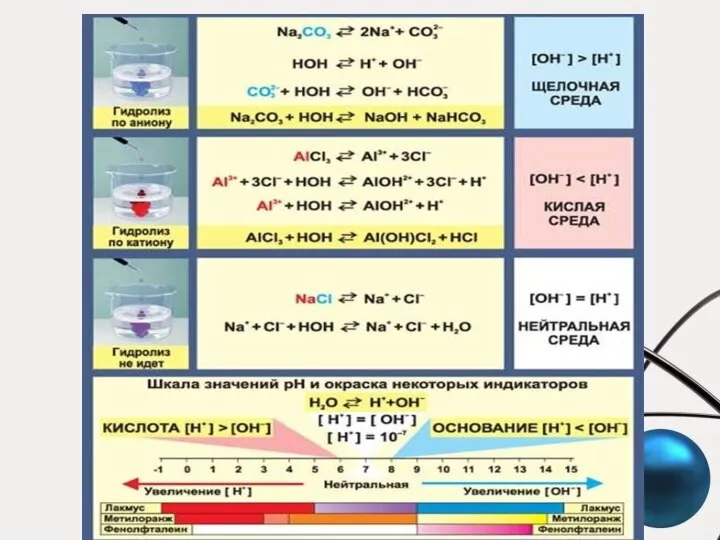
- 37. Гидролиз и по катиону и по аниону (NH4)2S + H2O NH3∙H2O + NH4HS pKa(HS-) = 14.7;
- 38. Гидролиз и по катиону и по аниону Необратимый гидролиз – частный случай гидролиза и по катиону
- 39. Степень гидролиза Nh ― число ионов, подвергшихся гидролизу; N ― число ионов, способных к гидролизу αh
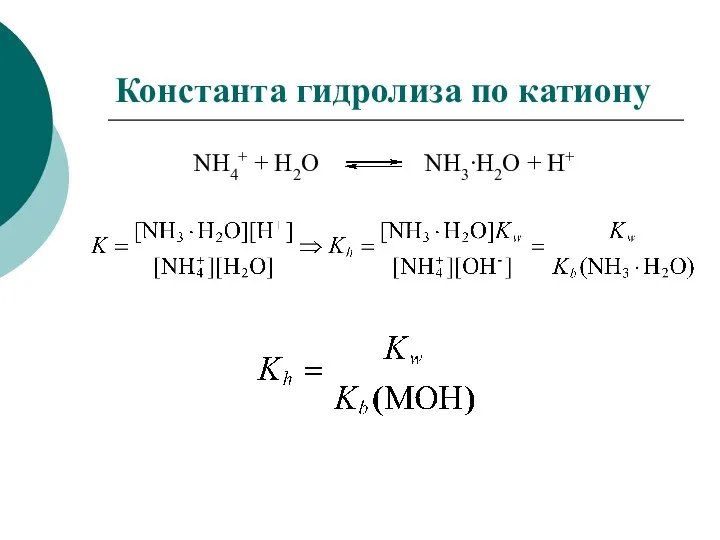
- 40. Константа гидролиза по катиону NH4+ + H2O NH3∙H2O + H+
- 41. Константа гидролиза по аниону CN– + H2O HCN + OH– [H2O] = 55,5 моль/л
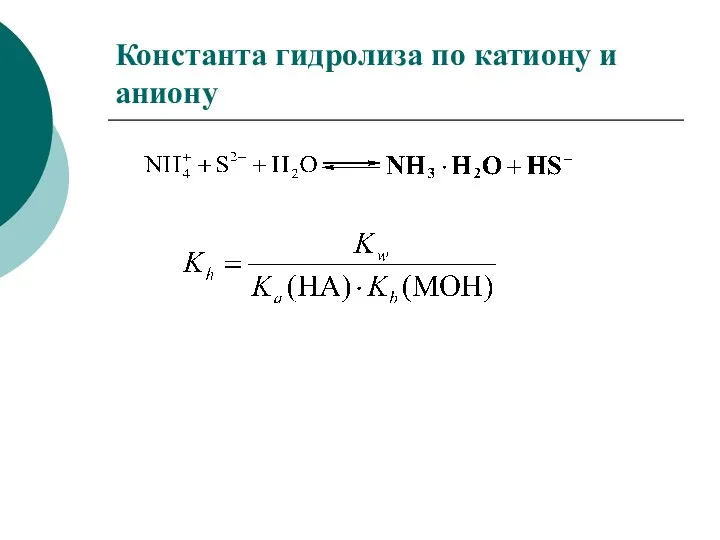
- 42. Константа гидролиза по катиону и аниону
- 43. Факторы, влияющие на степень гидролиза соли С увеличением Ka (Kb) степень гидролиза соли уменьшается С увеличением
- 44. Окислительно-восстановительные реакции Окислительно-восстановительные реакции (ОВР) – реакции переноса электронов от одних частиц к другим. При этом
- 45. Сопряжённые окислители и восстановители Red1 и Ox1, Red2 и Ox2 – сопряжённые восстановители и и окислители
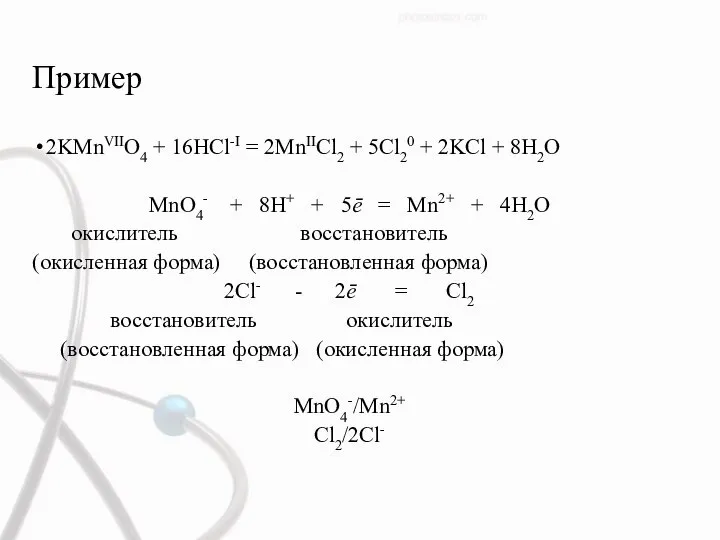
- 46. Пример 2KMnVIIO4 + 16HCl-I = 2MnIICl2 + 5Cl20 + 2KCl + 8H2O MnO4- + 8H+ +
- 47. Типы ОВР Межмолекулярные I20 + 5Cl20 + 6H2O = 10HCl-I + 2HIVO3 8KI-I + 5H2SVIO4(конц.) =
- 48. Окислители Простые вещества: F2, O3 Вещества с элементами в высших степенях окисления: HNVO3, H2SVIO4, KMnVIIO4, HClVIIO4,
- 49. Восстановители Простые вещества: металлы Вещества с атомами в низших степенях окисления: Na2S-II, Na2Se-II, KI-I, KBr-I, NaH-I,
- 50. Направление ОВР ОВР протекает самопроизвольно, если ΔrG Для полуреакции nOx + zē mRed ΔrG = ΔrH
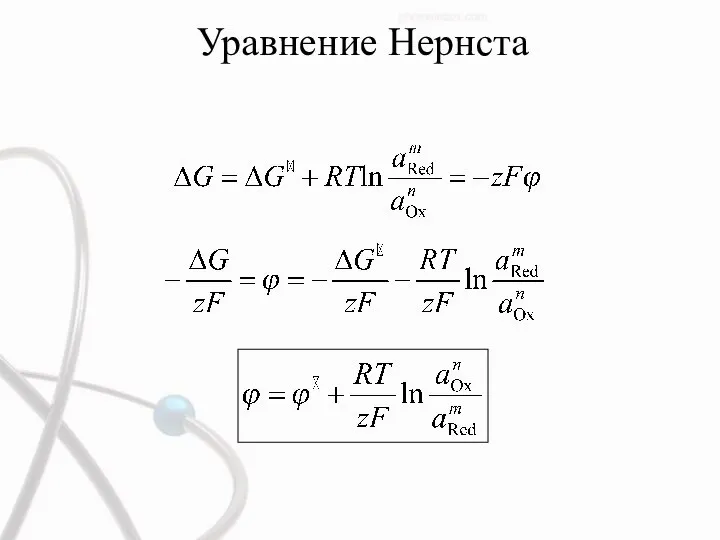
- 51. Уравнение Нернста
- 52. Самопроизвольное протекание ОВР Для самопроизвольной химической реакции E = φвосстановление – φокисление > 0 Для предварительной
- 53. Стандартный водородный электрод 2H+ + 2ē → H2
- 54. Гальванические элементы (электрохимические цепи) Гальванический элемент – устройство, состоящее из двух соединённых между собой полуэлементов (электродов),
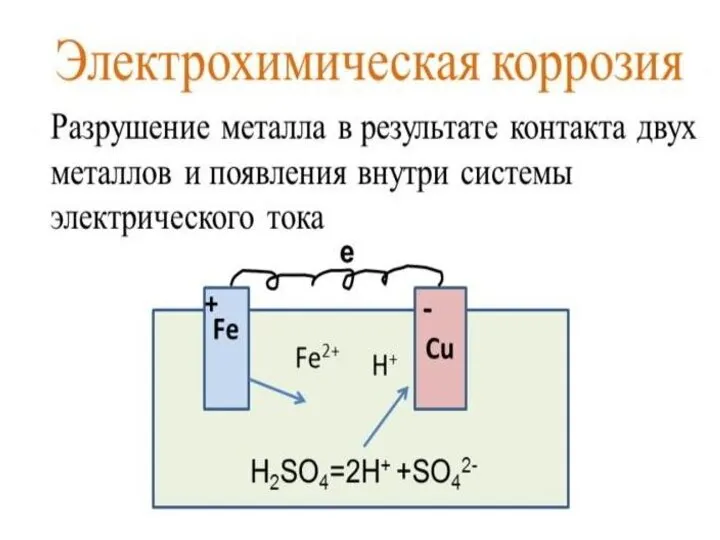
- 61. Химическая коррозия металлов в различных средах
- 68. Коррозия металлов в солевых растворах Основные причины коррозии металлов в природной воде В большинстве случаев следует
- 69. Zn + CuCl2 + H2O 1) Оценим возможность окисления цинка катионами меди Cu2+, т.е возможность протекания
- 71. Скачать презентацию






























![Константа гидролиза по аниону CN– + H2O HCN + OH– [H2O] = 55,5 моль/л](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/931667/slide-40.jpg)
























 Клуб юных химиков. Школа №3
Клуб юных химиков. Школа №3 Анализ образца доломита методами аналитической химии
Анализ образца доломита методами аналитической химии Гипертекст как средство развития познавательной активности учащихся на уроках химии Синицына Елена Александровна МОУ «Средняя
Гипертекст как средство развития познавательной активности учащихся на уроках химии Синицына Елена Александровна МОУ «Средняя  Получение алканов
Получение алканов Практика по химии
Практика по химии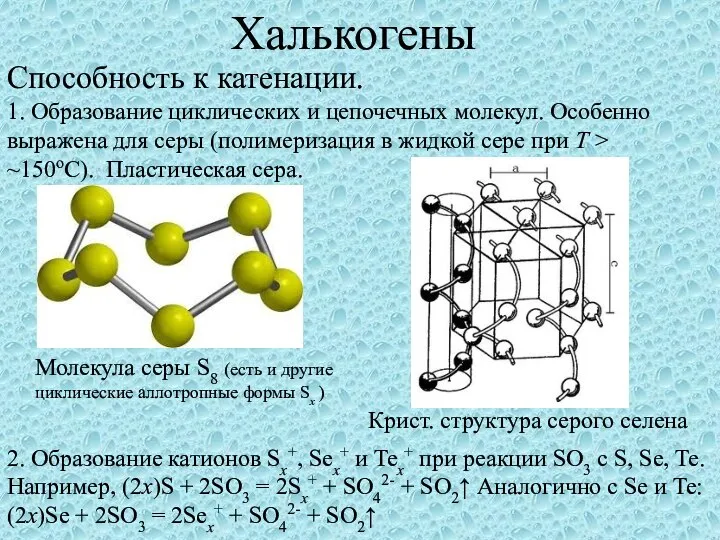 Халькогены. Способность к катенации
Халькогены. Способность к катенации Массовая доля химического элемента
Массовая доля химического элемента Щелочноземельные металлы
Щелочноземельные металлы Презентация по Химии "Быль о каучуке"
Презентация по Химии "Быль о каучуке"  Галогеналканы и реакции отщепления
Галогеналканы и реакции отщепления Соли: получение
Соли: получение Химия на войне
Химия на войне Кислород – это самый распространенный на нашей планете элемент
Кислород – это самый распространенный на нашей планете элемент карбоновые кислоты
карбоновые кислоты Современное представление о строении атома, S- и P- орбитали
Современное представление о строении атома, S- и P- орбитали Окислители в пиросоставах
Окислители в пиросоставах Презентация на тему Химические свойства оксидов
Презентация на тему Химические свойства оксидов  Применение серы, хлора, углерода
Применение серы, хлора, углерода Массовая доля химич элемента
Массовая доля химич элемента Фенол
Фенол Углеводы
Углеводы Решение задач на примере работы реакторов для реализации гетерогенных некаталитических процессов. Практическая работа
Решение задач на примере работы реакторов для реализации гетерогенных некаталитических процессов. Практическая работа Технологии получения и преобразования текстильных материалов. Синтетические волокна (9 класс)
Технологии получения и преобразования текстильных материалов. Синтетические волокна (9 класс) Алкины
Алкины Кислотно-основные взаимодействия
Кислотно-основные взаимодействия Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Ковалентная связь между одинаковыми атомами неметаллов
Ковалентная связь между одинаковыми атомами неметаллов Морфологогия минералов
Морфологогия минералов