Содержание
- 2. КАЛИЙ
- 3. Ка́лий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева,
- 4. Нахождение в природе В свободном состоянии не встречается. Породообразующий элемент входит в состав слюд, полевых шпатов,
- 5. Физические свойства Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок.
- 6. Химические свойства Калий проявляет типичные металлические свойства и очень химически активен, является сильным восстановителем. На воздухе
- 8. Применение Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах,
- 9. Месторождения Крупнейшие месторождения калия находятся на территории Канады (производитель PotashCorp), России (ОАО «Уралкалий», г.Березники, ОАО «Сильвинит»,
- 10. Калий- натриевый насос Обмен осуществляется при помощи специальных белков, образующих в мембране так называемые каналы. На
- 11. Он нормализует углеводный и солевой, а также водно-солевой обмен в организме. Вот почему недостаток калия обязательно
- 12. Источник калия: шпинат, огурцы, морковь, лук, петрушка, спаржа, хрен, одуванчик, чеснок, черная смородина, бананы, капуста, редис,
- 13. МАРГАНЕЦ
- 14. Ма́рганец — элемент побочной подгруппы седьмой группы четвёртого периода периодической системы химических элементовД. И. Менделеева с
- 15. Химический символ Mn Атомный номер 25 Относительная атомная масса 54,9380 ± 0,0001 Стабильный изотоп 55Mn Электронное
- 16. ЭЛЕКТРОННОЕ СТРОЕНИЕ
- 17. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ
- 19. Реагирует с соляной и серной кислотой: Mn+2HCl -> MnCl2+H2 Mn+H2SO4 -> MnSO4+H2 С концентрированной серной кислотой
- 20. С хлором, бромом и иодом марганец реагирует с образованием дигалогенидов: Mn + Cl2 = MnCl2 При
- 21. Химические свойства При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде: Mn + O2 →
- 22. Твёрдый Хрупкий Серебристо-белого цвета Проводит электрический ток Температура плавления 1245°С температура кипения 2200°С плотность 7,44 г/см3
- 23. пиролюзит MnO2 манганит MnO2·Mn(OH)2 браунит Mn2O3 родохрозит MnCo3 псиломелан mMnO·MnO2·nH2O и ряд других. МИНЕРАЛЫ МАРГАНЦА
- 24. 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной
- 25. ПОЛУЧЕНИЕ Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита: Восстановлением железосодержащих оксидных руд марганца коксом.
- 26. Чёрная металлургия Производство ферритных материалов Изготовление реостатов Термоэлектрический материал Покрытия, обеспечивающие антикоррозионную защиту ПРИМЕНЕНИЕ
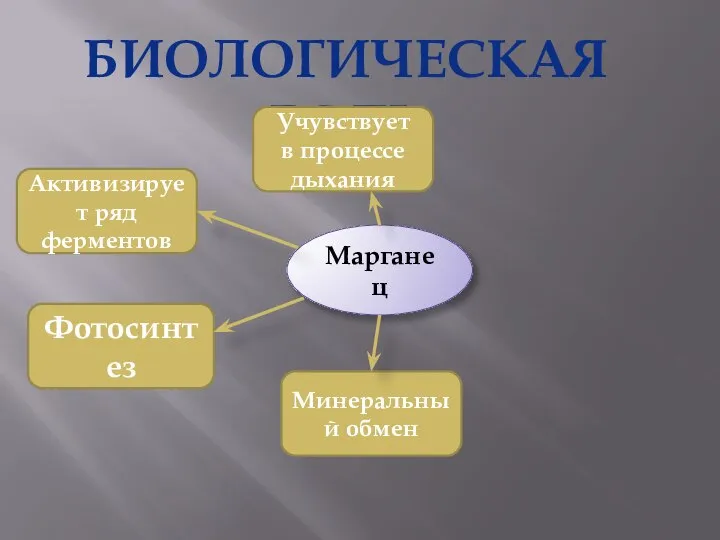
- 27. БИОЛОГИЧЕСКАЯ РОЛЬ Марганец Активизирует ряд ферментов Фотосинтез Минеральный обмен Учувствует в процессе дыхания
- 29. Скачать презентацию
























 Неорганическая и органическая химия
Неорганическая и органическая химия Химические явления
Химические явления Строение и физические свойства металлов
Строение и физические свойства металлов Презентация на тему Электрохимический ряд напряжений металлов
Презентация на тему Электрохимический ряд напряжений металлов  Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1 Общая характеристика металлов
Общая характеристика металлов Prezentatsia_lektsia_Reaktora_2_Materialny_balans
Prezentatsia_lektsia_Reaktora_2_Materialny_balans Химия. Электролитическая диссоциация. (9 класс)
Химия. Электролитическая диссоциация. (9 класс)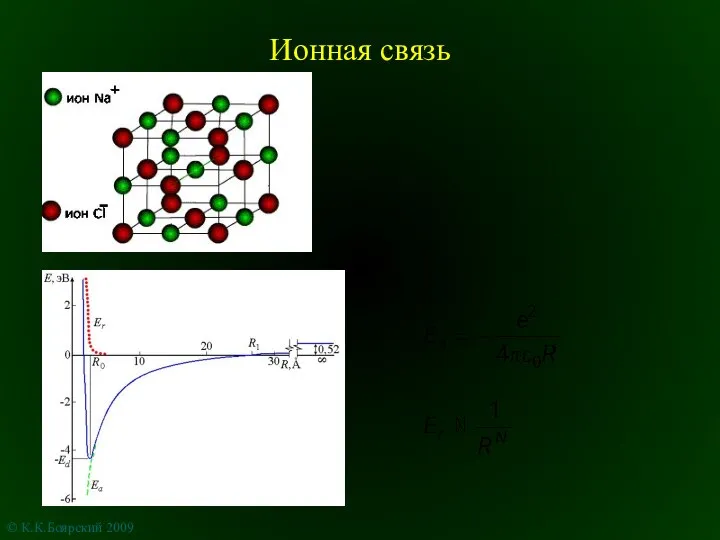 Ионная связь
Ионная связь Образовательные технологии, используемые на уроках химии для повышения мотивации обучения
Образовательные технологии, используемые на уроках химии для повышения мотивации обучения Что такое электрон?
Что такое электрон? Практическая работа 1. ХТП. Классификация химических реакций
Практическая работа 1. ХТП. Классификация химических реакций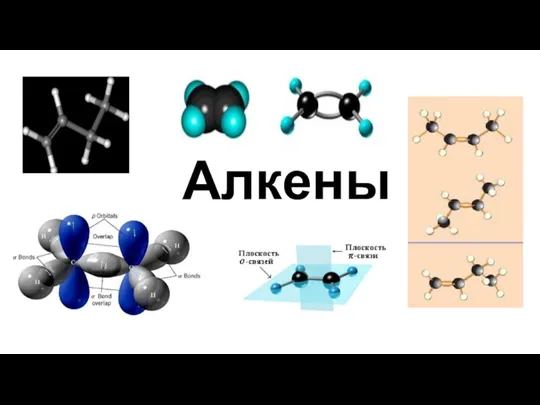 Алкены. Гомологический ряд алкенов. Изомерия алкенов. Химические свойства алкенов
Алкены. Гомологический ряд алкенов. Изомерия алкенов. Химические свойства алкенов Презентация на тему Привычная и удивительная поваренная соль
Презентация на тему Привычная и удивительная поваренная соль  Презентация1
Презентация1 Будова електронних оболонок і властивості хіиічних елементів. (8 клас)
Будова електронних оболонок і властивості хіиічних елементів. (8 клас)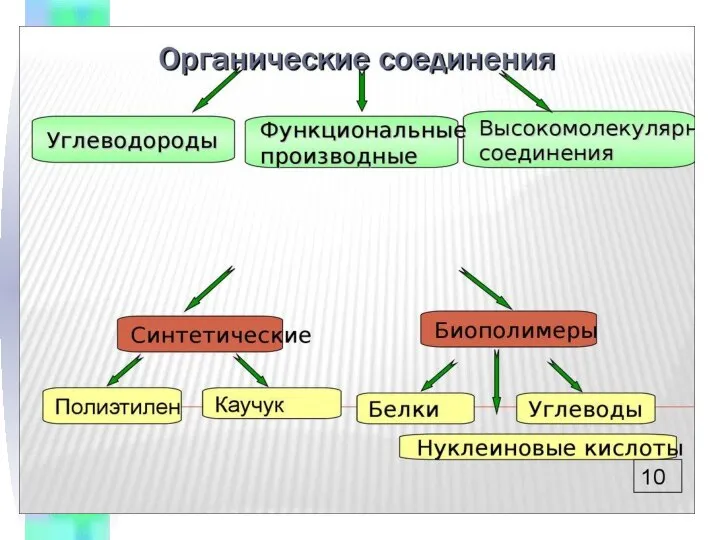 Спирты и их производные
Спирты и их производные Турнир смекалистых. Все о кислотах
Турнир смекалистых. Все о кислотах Номенклатура алканов разветвленного строения
Номенклатура алканов разветвленного строения Теория химического строения А. М. Бутлерова
Теория химического строения А. М. Бутлерова Предельные углеводороды. Алканы, насыщенные углеводороды, парафины, циклоалканы
Предельные углеводороды. Алканы, насыщенные углеводороды, парафины, циклоалканы Классификация загрязняющих веществ по фазово-дисперсному составу
Классификация загрязняющих веществ по фазово-дисперсному составу ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ
ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ Свойства воды
Свойства воды Массообменные процессы
Массообменные процессы Солевые кристаллы
Солевые кристаллы Оксиды. Физические свойства
Оксиды. Физические свойства Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота