Содержание
- 2. Открытие галогенов Фтор в свободном виде получил впервые в 1866 г. французский химик Анри Муассан, лауреат
- 3. Нахождение в природе
- 4. ОБЩАЯ ХАРАКТЕРИСТИКА ГАЛОГЕНОВ Галогены – это естественная группа элементов , расположенных в главной подгруппе VII группы.
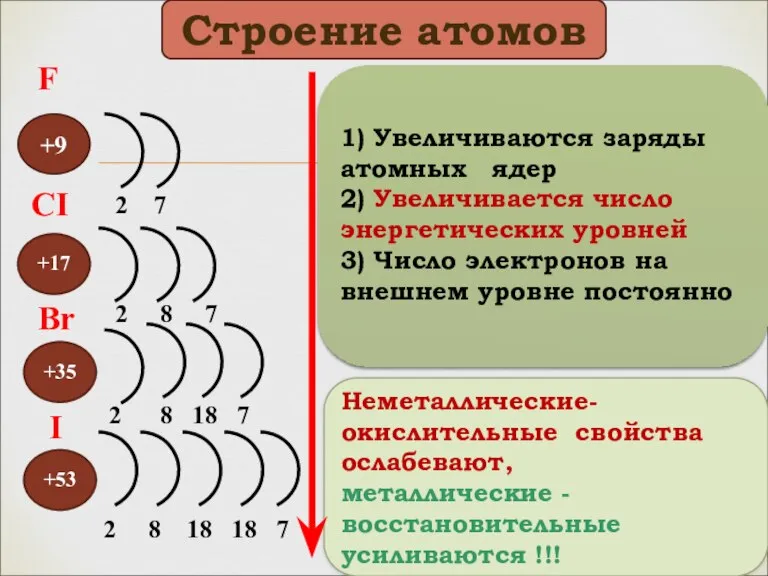
- 5. +9 +53 +35 +17 Неметаллические-окислительные свойства ослабевают, металлические -восстановительные усиливаются !!! 2 7 2 8 7
- 6. F 1S22S22P5 S P CI 1S22S22P63S23P5 Br I …4S24P5 …5S25P5 Электронные формулы Вывод: галогены - р
- 7. CI2 Br2 I2 F2 Простые вещества
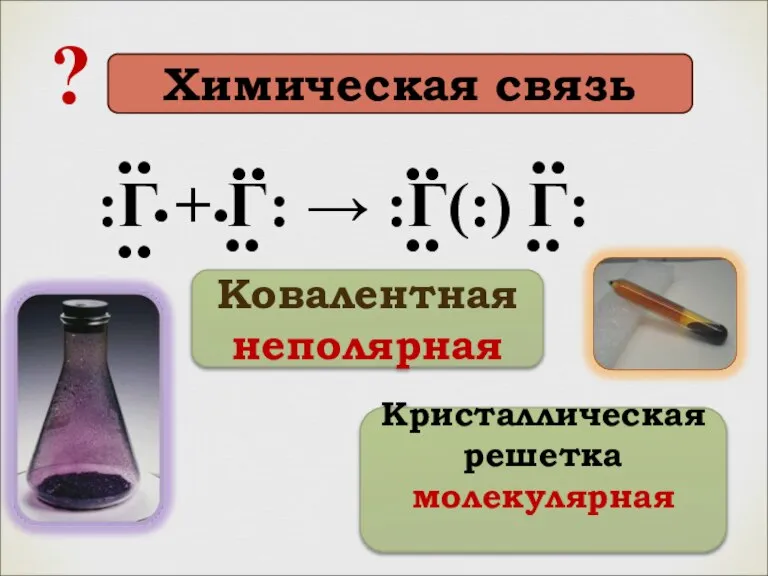
- 8. :Г + Г: → :Г(:) Г: .. .. .. .. .. .. .. .. . .
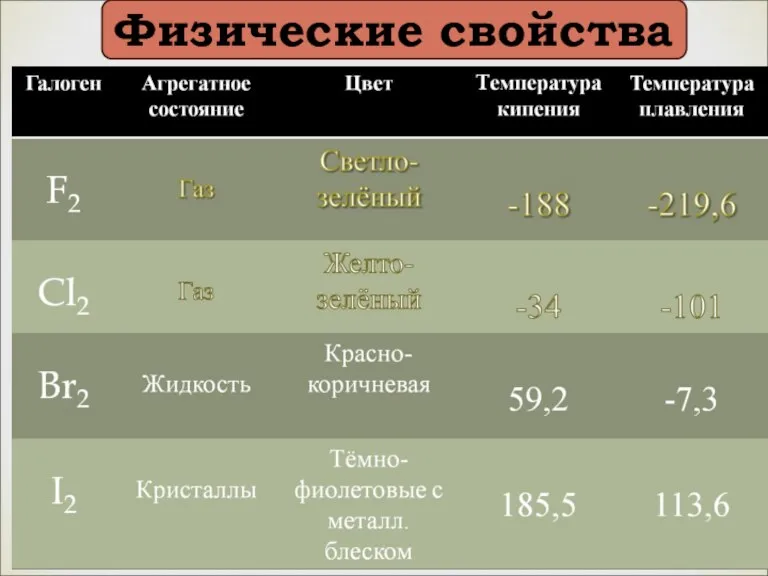
- 10. Физические свойства
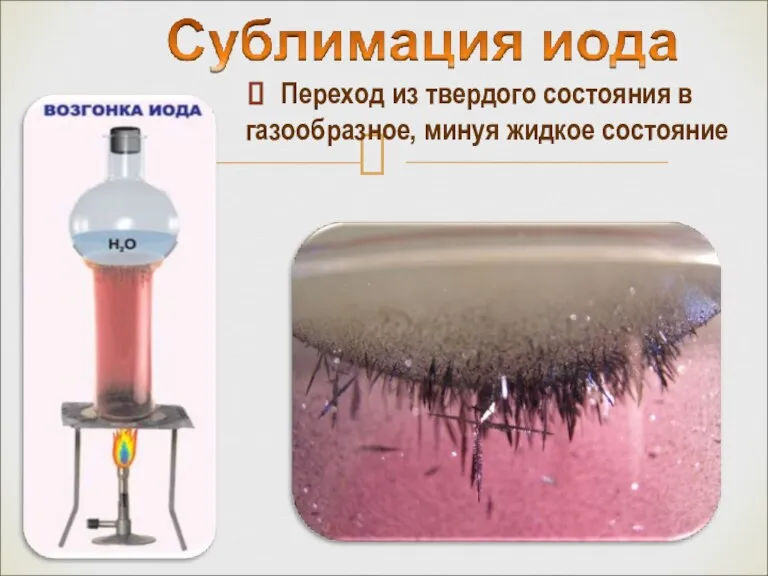
- 11. Переход из твердого состояния в газообразное, минуя жидкое состояние
- 12. 1.Взаимодействие с металлами Химические свойства 2 Na0 + CI20 = 2 NaCI + - CI20 окислитель
- 13. Cu0 + I20 = Cu2+I2- 2Fe0 + 3Br20= 2Fe3+Br3- Что является окислителем?
- 14. 2.Взаимодействие с водородом Н20 + Г20 = 2Н+ Г- Н20 + CI20 = 2НCI Н20 +
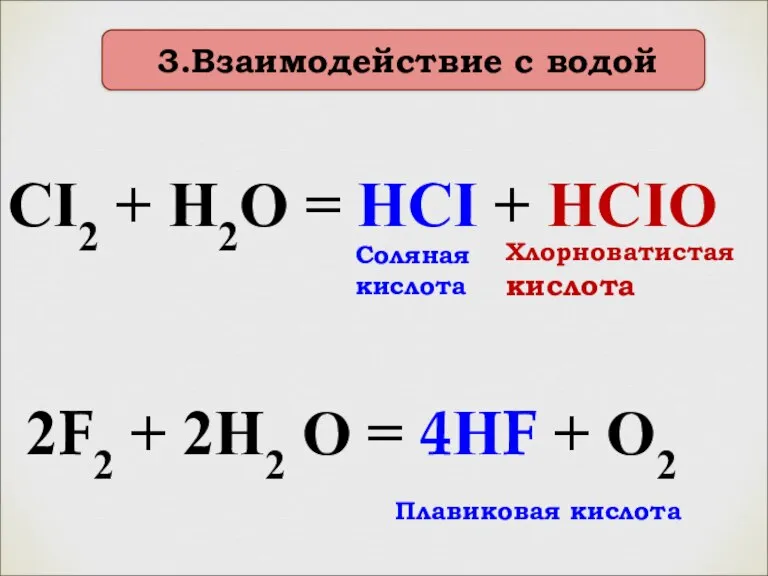
- 15. 3.Взаимодействие с водой CI2 + H2O = HCI + HCIO Хлорноватистая кислота Соляная кислота 2F2 +
- 16. 4.Взаимодействие с растворами солей галогенов: CI2 F2 Br2 I2 CI2 + 2NaBr = 2 NaCl +
- 17. Применение галогенов
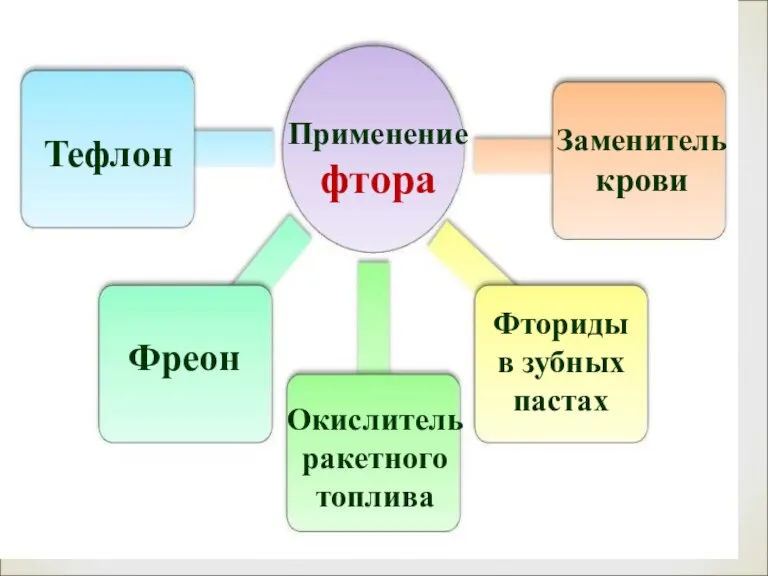
- 18. Применение фтора Тефлон Фреон Окислитель ракетного топлива Заменитель крови Фториды в зубных пастах
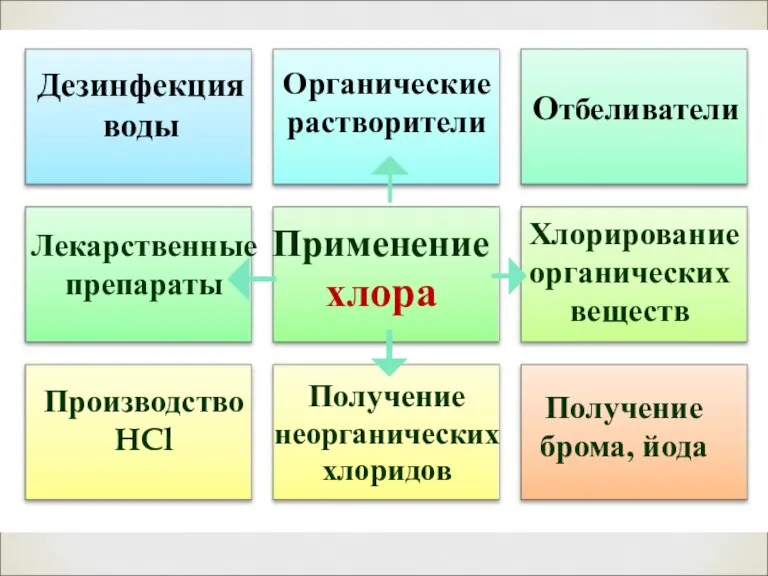
- 19. Применение хлора Отбеливатели Производство HCl Получение брома, йода Дезинфекция воды Органические растворители Лекарственные препараты Хлорирование органических
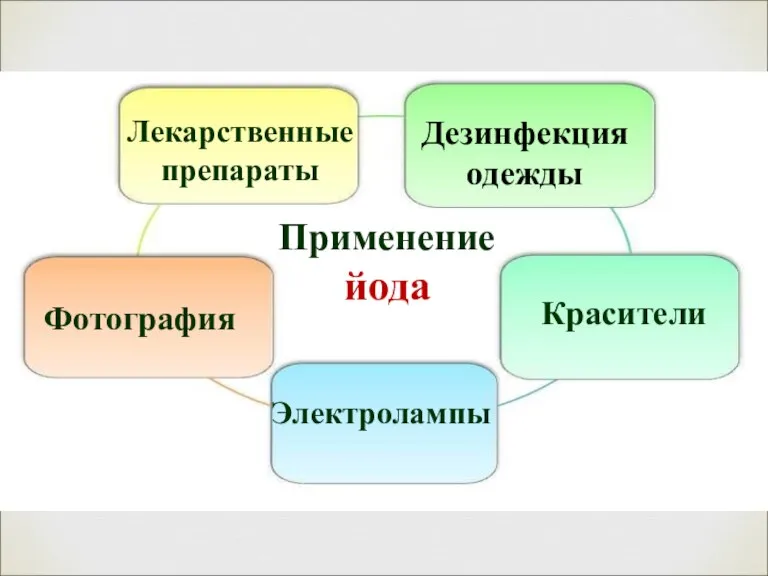
- 20. Применение йода Лекарственные препараты Фотография Красители Дезинфекция одежды Электролампы
- 22. Скачать презентацию










 Вдоль по радуге
Вдоль по радуге Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Anorganická chemie
Anorganická chemie Железо в нашей жизни
Железо в нашей жизни Сера и его соединения
Сера и его соединения Алканы: строение, номенклатура, изомерия, физические свойства
Алканы: строение, номенклатура, изомерия, физические свойства Презентация на тему Строение газообразных, жидких и твердых тел
Презентация на тему Строение газообразных, жидких и твердых тел  Презентация на тему Йод
Презентация на тему Йод  Массовая доля элемента, 8 класс
Массовая доля элемента, 8 класс Метод проекта на уроках химии и биологии и внеурочное время
Метод проекта на уроках химии и биологии и внеурочное время Методы восстановления. Формирование СН-связей декарбоксилированием и декарбонилированием
Методы восстановления. Формирование СН-связей декарбоксилированием и декарбонилированием Коррозия металлов
Коррозия металлов Презентация по Химии "Алмаз"
Презентация по Химии "Алмаз"  Электронная структура атома углерода. Лекция 3
Электронная структура атома углерода. Лекция 3 Гармонизации терминологии аналитической химии с использованием электронной системы на основе MS WSS (Windows SharePoint Services) Широкова В.И.,
Гармонизации терминологии аналитической химии с использованием электронной системы на основе MS WSS (Windows SharePoint Services) Широкова В.И.,  5кл 20.10практична робота
5кл 20.10практична робота Строение и свойства этилена
Строение и свойства этилена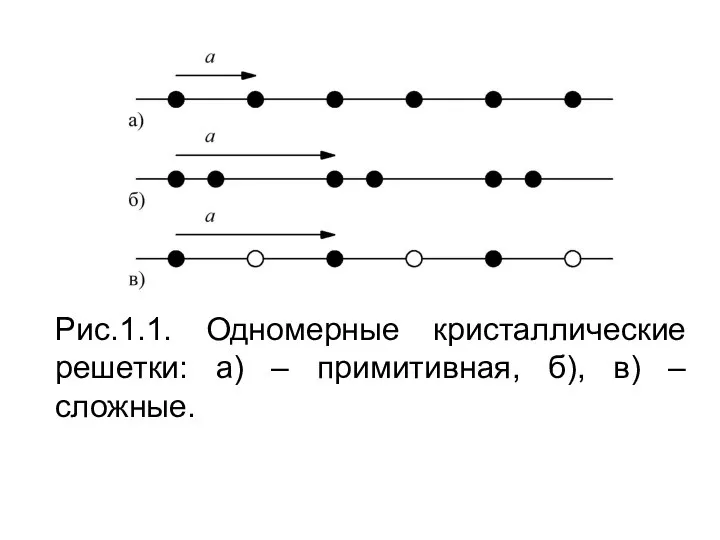 Кристаллические решётки
Кристаллические решётки Оксиды. Классификация, химические и физические свойства. Индивидуальные свойства
Оксиды. Классификация, химические и физические свойства. Индивидуальные свойства Основания и кислоты в повседневной жизни
Основания и кислоты в повседневной жизни Металдар мен қорытпалардың құрылысы және қасиеттері
Металдар мен қорытпалардың құрылысы және қасиеттері Галогены. 9 класс
Галогены. 9 класс Ископаемые углеводороды
Ископаемые углеводороды Кремневая кислота и ее соли
Кремневая кислота и ее соли Классификация силикатов
Классификация силикатов Таблица Д.И. Менделеева
Таблица Д.И. Менделеева Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Растворы электролитов (окончание)
Растворы электролитов (окончание)