Содержание
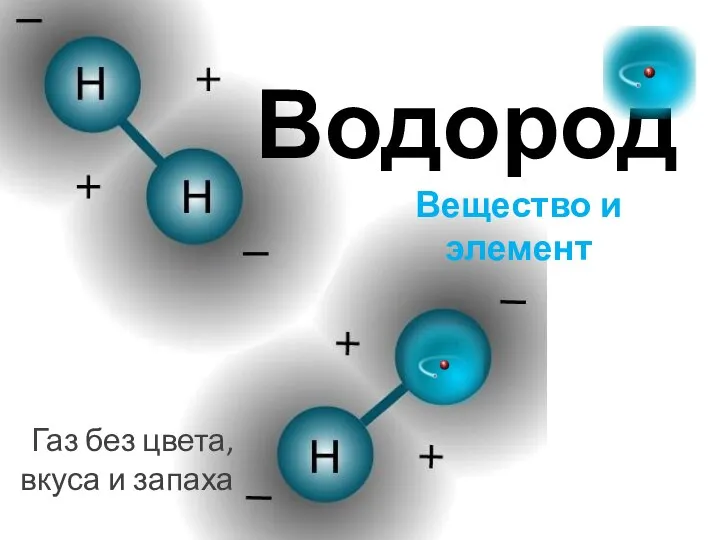
- 4. Водород Вещество и элемент Газ без цвета, вкуса и запаха
- 5. 2. Историческая справка 1766 г. – водород открыл Г. Кавендиш 1784 г. – А. Лавуазье назвал
- 6. Антуан Лоран Лавуазье 1743–1794 гг. Генри Кавендиш 1731–1810 гг.
- 8. Водород
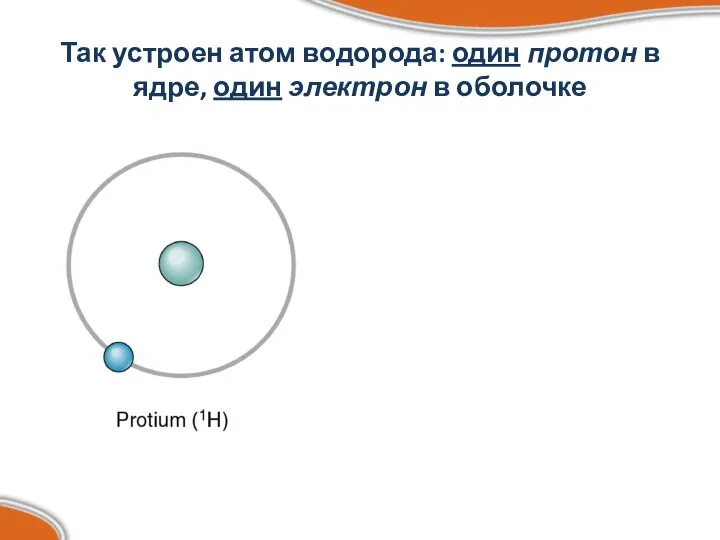
- 9. Так устроен атом водорода: один протон в ядре, один электрон в оболочке
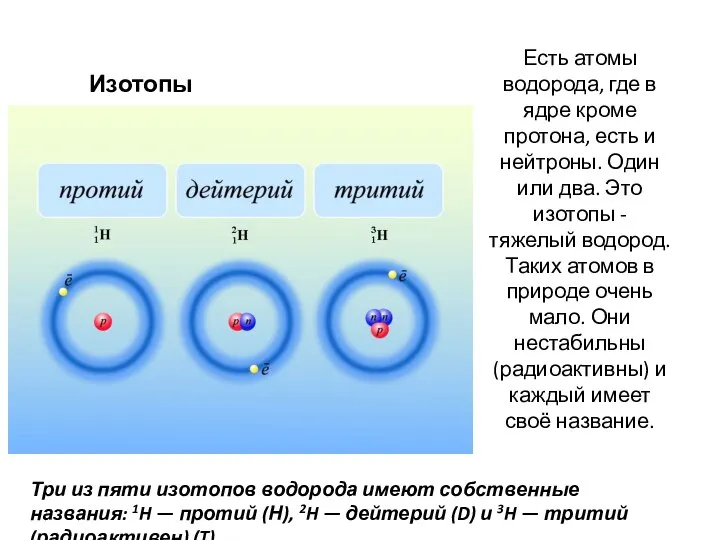
- 10. Есть атомы водорода, где в ядре кроме протона, есть и нейтроны. Один или два. Это изотопы
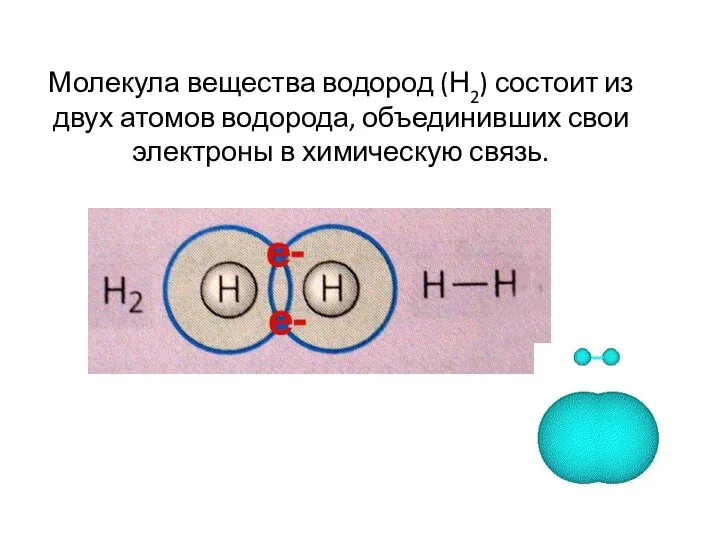
- 11. Молекула вещества водород (Н2) состоит из двух атомов водорода, объединивших свои электроны в химическую связь.
- 12. Физические свойства Н2 Газ без цвета, вкуса и запаха. Легче воздуха в 14,5 раз. Плохо растворим
- 13. Физические свойства t0пл. -259,10 С; t0 кип. -2530 С; теплопроводность в 7 раз больше чем воздуха;
- 14. Получение водорода В лаборатории: Взаимодействие цинка с соляной кислотой: Zn+2HCl=ZnCl2+ H2 Взаимодействие калия с водой: 2К+2H2O=2KOH+H2
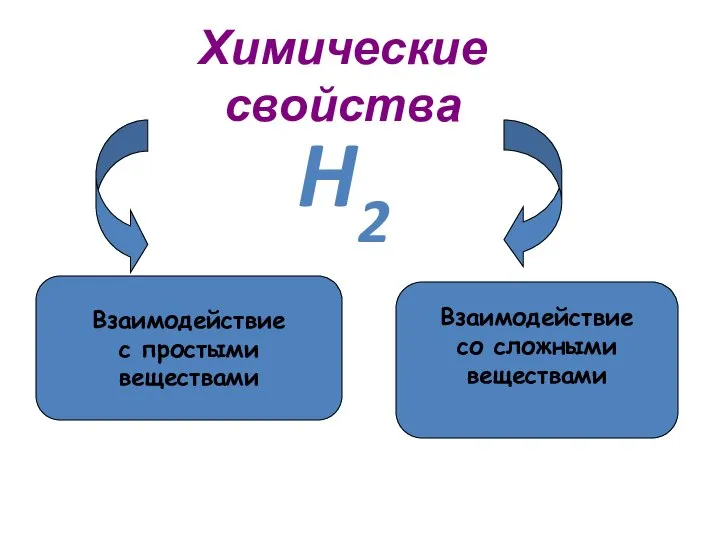
- 15. Химические свойства Взаимодействие с простыми веществами Взаимодействие со сложными веществами H2
- 16. Химические свойства Взаимодействие с металлами: Ca + H2 = CaH2 CaH2 + 2H2O = Ca(OH)2 +
- 17. I.Взаимодействие с простыми веществами 1) Взаимодействие с неметаллами 1. O2 + 2H2 = 2Н2О 2. S
- 18. Смесь водорода с одним объемом кислорода – гремучий газ Смесь водорода и воздуха – взрывоопасна! Обычно
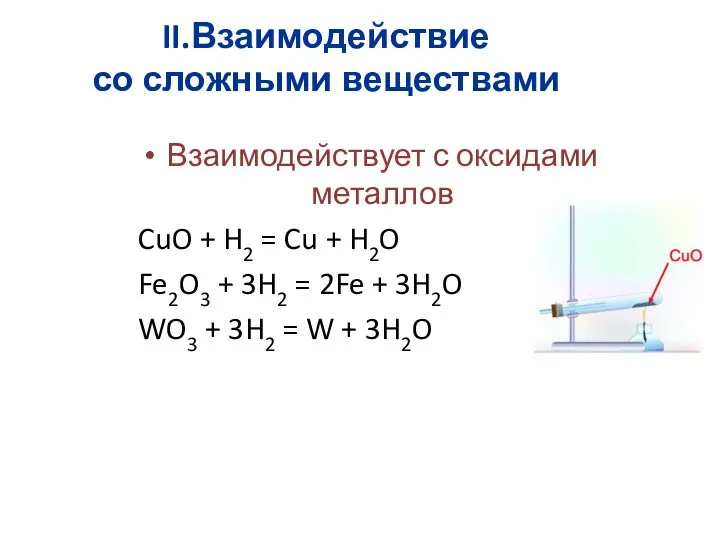
- 19. II.Взаимодействие со сложными веществами Взаимодействует с оксидами металлов CuO + H2 = Cu + H2O Fe2O3
- 20. ПРОВЕРЬ СЕБЯ 1. Водород проявляет степень окисления в соединениях: А) +1 и -1; Б) +2 и
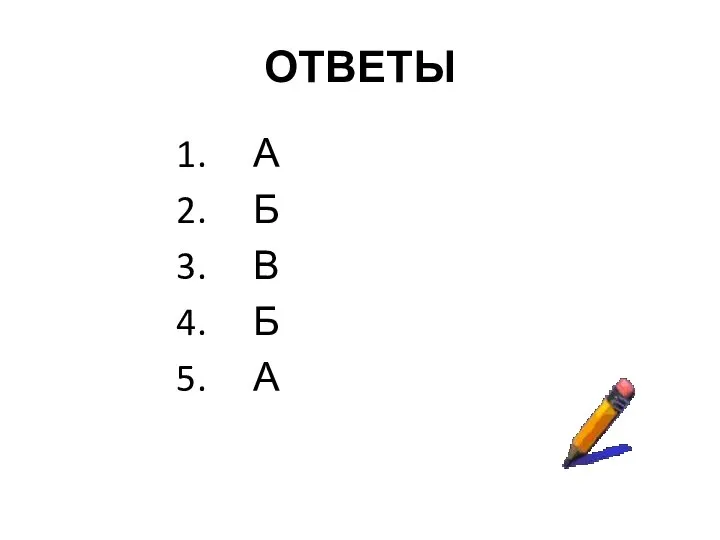
- 21. ОТВЕТЫ А Б В Б А
- 22. Допиши химические реакции и укажи их тип: 1. H2O2 = 6. HgO= 2. S + O2=
- 24. Скачать презентацию













 Порядок в жидкостях
Порядок в жидкостях Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства
Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства Алмаз Подготовила: УЧЕНИЦА 9 «А» КЛАССА КАЗИЕВА МАРЖАН
Алмаз Подготовила: УЧЕНИЦА 9 «А» КЛАССА КАЗИЕВА МАРЖАН Карбоновые кислоты
Карбоновые кислоты Презентация на тему Валентные состояния атома углерода
Презентация на тему Валентные состояния атома углерода  Роль элементов 5 группы
Роль элементов 5 группы Презентация на тему Уксусная кислота
Презентация на тему Уксусная кислота  Гидролиз солей. Какие типы гидролиза возможны?
Гидролиз солей. Какие типы гидролиза возможны? Выращивание кристаллов соли (домашний эксперимент)
Выращивание кристаллов соли (домашний эксперимент) Белки
Белки Основные классы неорганических веществ
Основные классы неорганических веществ Химическая связь и строение вещества
Химическая связь и строение вещества Смог як хімічне явище
Смог як хімічне явище Презентация на тему Интеллект – мой выбор
Презентация на тему Интеллект – мой выбор  Изучение свойств азотной кислоты для учащихся 9 классов
Изучение свойств азотной кислоты для учащихся 9 классов Стекло. Технология изготовления стекла
Стекло. Технология изготовления стекла Вещество и тело. Атом и молекула. Свойства веществ. Простые и сложные вещества. Химический элемент
Вещество и тело. Атом и молекула. Свойства веществ. Простые и сложные вещества. Химический элемент Гипер-гипофосфатемия
Гипер-гипофосфатемия Алкины
Алкины Оксиды, их классификация. Свойства оксидов в свете теории электролитической диссоциации
Оксиды, их классификация. Свойства оксидов в свете теории электролитической диссоциации Физические и химические свойства алкенов
Физические и химические свойства алкенов Презентация на тему Неорганічні речовини живих організмів
Презентация на тему Неорганічні речовини живих організмів  Единые смеси
Единые смеси Какую воду мы пьем
Какую воду мы пьем Кристаллическое состояние воды - лёд
Кристаллическое состояние воды - лёд Объёмный анализ
Объёмный анализ ліпіди
ліпіди Окислительно-восстановительные реакции
Окислительно-восстановительные реакции