Слайд 2Цель урока:
Выяснить, что такое скорость химической реакции.
Выяснить, какие факторы и как влияют

на скорость химической реакции.
Слайд 3
Скорость химической реакции:
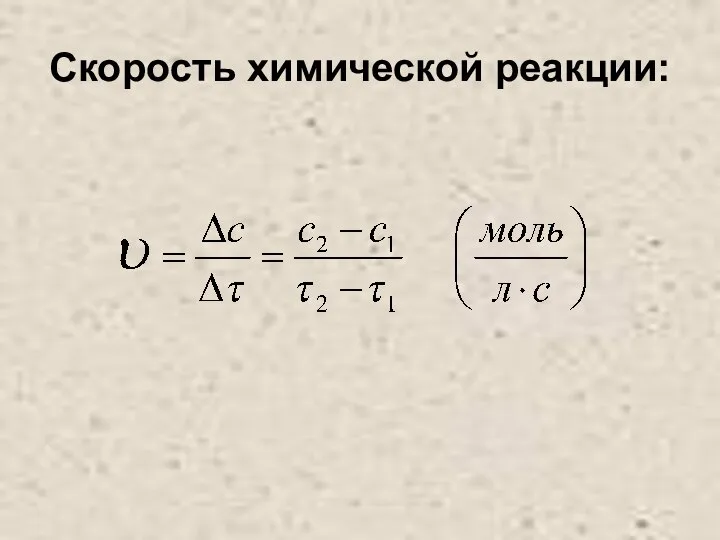
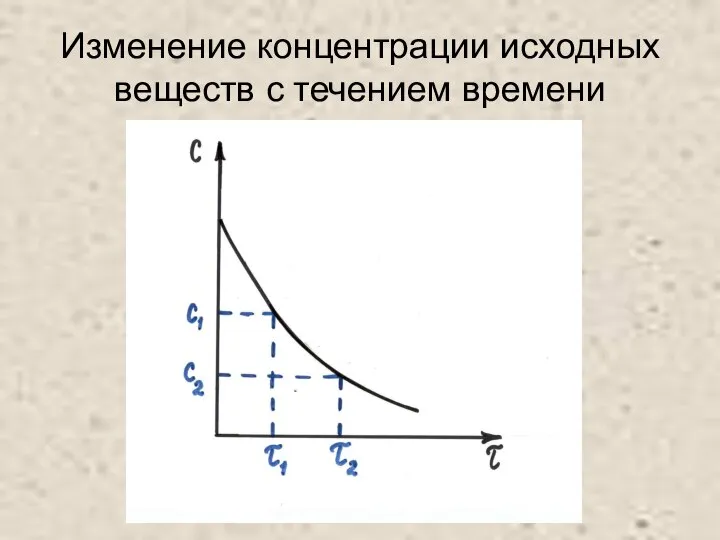
Слайд 4Изменение концентрации исходных веществ с течением времени
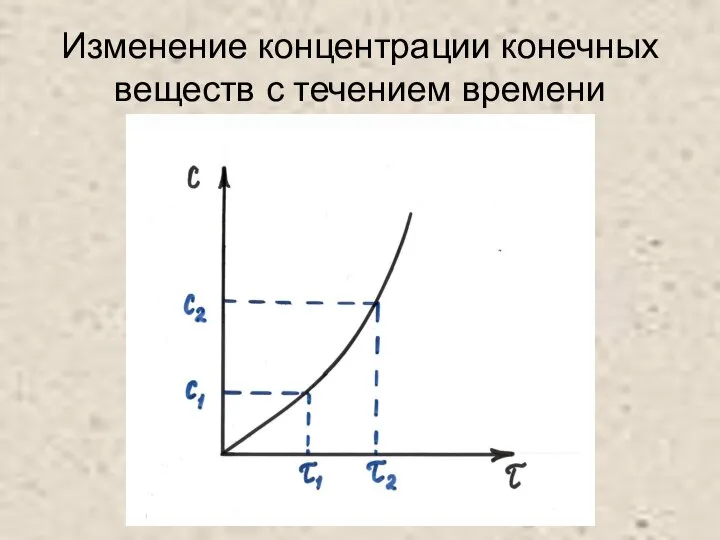
Слайд 5Изменение концентрации конечных веществ с течением времени
Слайд 6Скорость химической реакции в гомогенной системе:

Слайд 7Скорость химической реакции в гетерогенной системе:

Слайд 8Взаимодействие водорода с кислородом
2 моль H2 и 1 моль О2 при 25˚
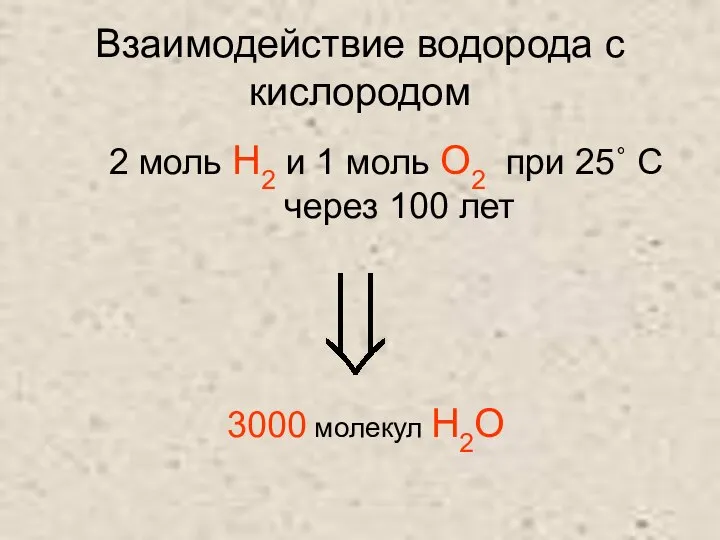
С
через 100 лет
3000 молекул H2О
Слайд 9Влияние на скорость реакции
различных факторов

Слайд 101) Природа реагирующих веществ
Zn + 2HCl = ZnCl2 + H2 ↑
Zn
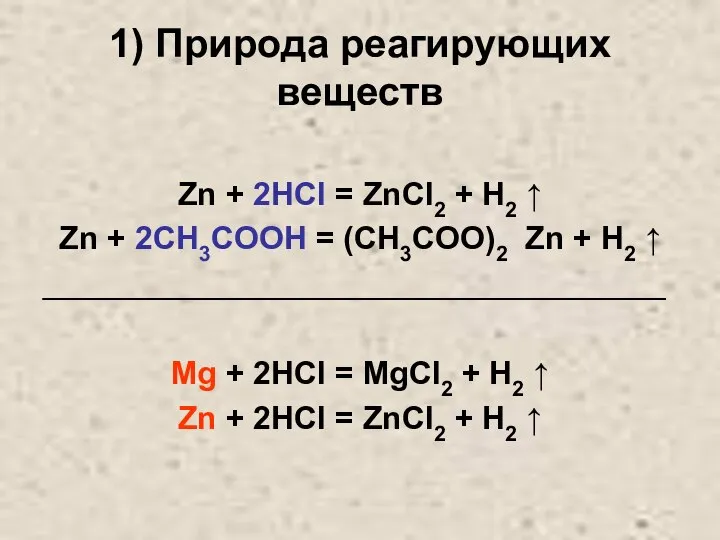
+ 2CH3COOH = (CH3COO)2 Zn + H2 ↑
___________________________________
Mg + 2HCl = MgCl2 + H2 ↑
Zn + 2HCl = ZnCl2 + H2 ↑
Слайд 112) Концентрация реагирующих веществ
Zn + 2HCl = ZnCl2 + H2 ↑
а) раствор

HCl
б) концентрированная HCl
Слайд 12Закон «действующих масс»:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.

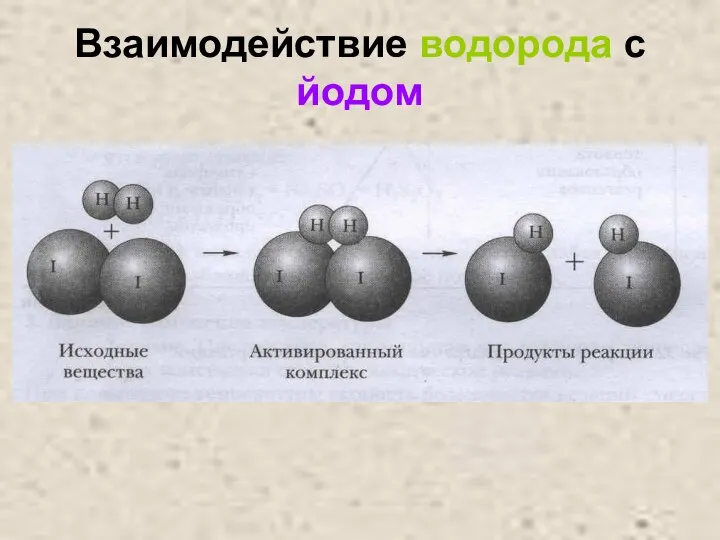
Слайд 13Взаимодействие водорода с азотом

Слайд 15
3) Величина поверхности соприкосновения реагирующих веществ
CaCO3 + 2HCl = CaCl2 + H2O

+ CO2 ↑
а) кусочек CaCO3
б) измельченный CaCO3
Слайд 164) Температура
Правило Вант-Гоффа:
При повышении температуры на каждые 100 C скорость большинства

реакций увеличивается в 2-4 раза.
Слайд 17Правило Вант-Гоффа:
Где - температурный коэффициент

Слайд 18Задача:
Во сколько раз увеличится скорость реакции?

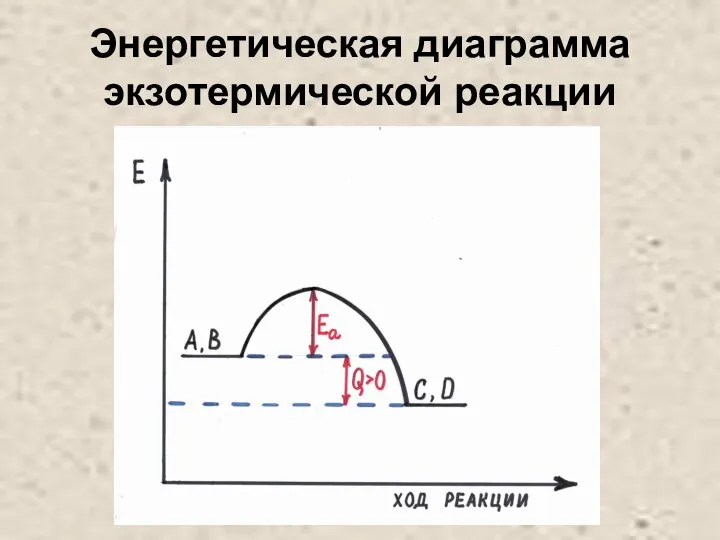
Слайд 24Энергетическая диаграмма экзотермической реакции
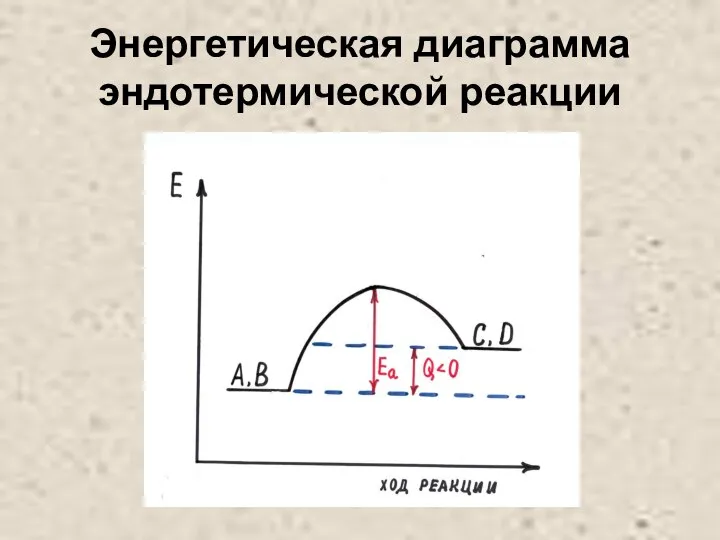
Слайд 25Энергетическая диаграмма эндотермической реакции
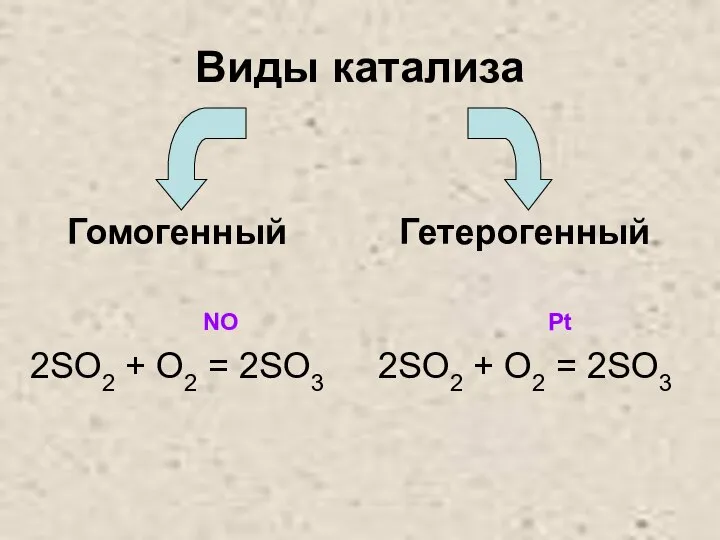
Слайд 26Виды катализа
Гомогенный
NO
2SO2 + O2 = 2SO3
Гетерогенный
Pt
2SO2 + O2 = 2SO3
Слайд 27Механизм действия катализаторов
Для гомогенного катализа:
K
A + B = AB
A + K

= [AK]
[AK] + B = AB + K
Слайд 28Окисление SO2 в SO3
NO
SO2 + ½ O2 = SO3
NO + ½

O2 = NO2
SO2 + NO2 = SO3 + NO
Слайд 29Разложение H2O2
раствор K2Cr2O7
2H2O2 = 2H2O + O2 ↑


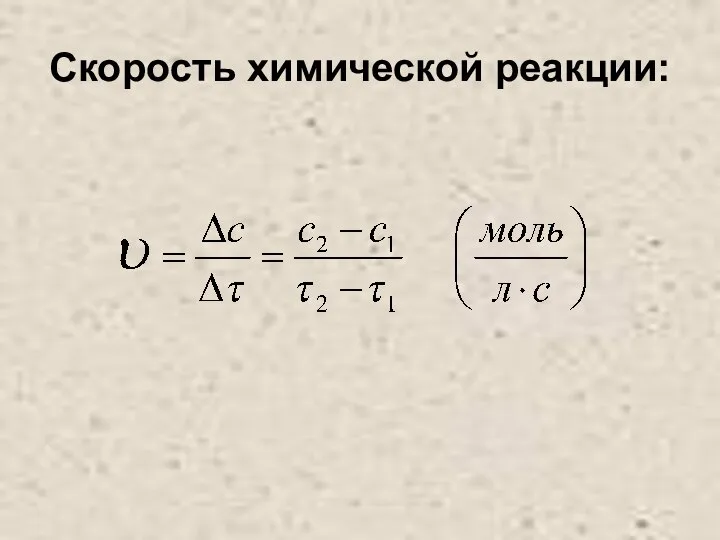























 Поверхностные и массовые силы. Вывод уравнения неразрывности сплошной однокомпонентной среды
Поверхностные и массовые силы. Вывод уравнения неразрывности сплошной однокомпонентной среды Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства
Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства Скорость химической реакции. Факторы, влияющие на скорость
Скорость химической реакции. Факторы, влияющие на скорость Нефть. Способы переработки нефти
Нефть. Способы переработки нефти Элемент протактиний
Элемент протактиний Презентация на тему Химия в разных науках
Презентация на тему Химия в разных науках  Металлы и неметаллы
Металлы и неметаллы Металлы 9 класс
Металлы 9 класс Углеводы
Углеводы Активные формы кислорода (АФК) Reactive Oxygen Species (ROS)
Активные формы кислорода (АФК) Reactive Oxygen Species (ROS) Щелочные металлы
Щелочные металлы Кислород
Кислород Изготовление слайма в домашних условиях
Изготовление слайма в домашних условиях lektsia_7
lektsia_7 Классы неорганических веществ. Игра для 9 класса
Классы неорганических веществ. Игра для 9 класса Решение экспериментальных задач по теме Основные классы неорганических соединений. Практическая работа № 4
Решение экспериментальных задач по теме Основные классы неорганических соединений. Практическая работа № 4 Растворение. Растворимость веществ в воде
Растворение. Растворимость веществ в воде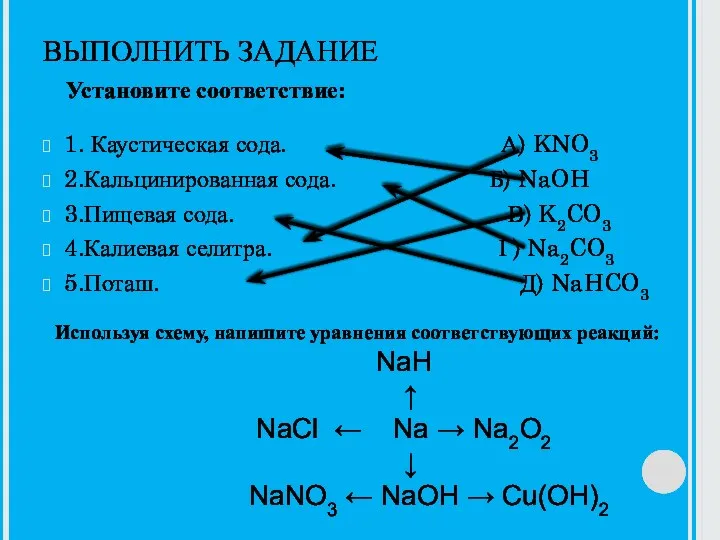 Каустическая сода
Каустическая сода Деформация аморфных и кристаллических полимеров
Деформация аморфных и кристаллических полимеров Структура металлов, сплавов, интерметаллидов и квазикристаллов
Структура металлов, сплавов, интерметаллидов и квазикристаллов Незаменимая уксусная кислота
Незаменимая уксусная кислота Оксид марганца
Оксид марганца Многоатомные спирты
Многоатомные спирты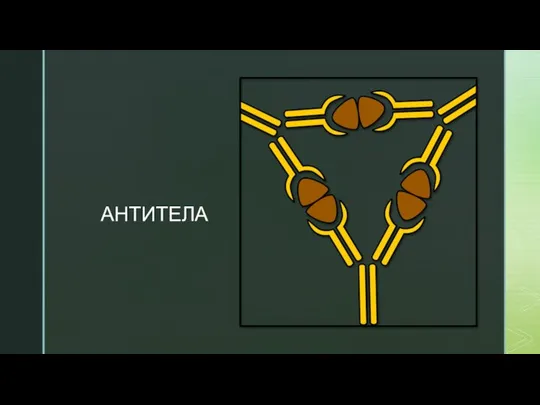 Антитела. Что такое антитела?
Антитела. Что такое антитела? Углеводы. Стереохимия углеводов в проекциях Фишера
Углеводы. Стереохимия углеводов в проекциях Фишера Энергетика химических реакций
Энергетика химических реакций Строение вещества
Строение вещества Гідроліз солей
Гідроліз солей