Содержание
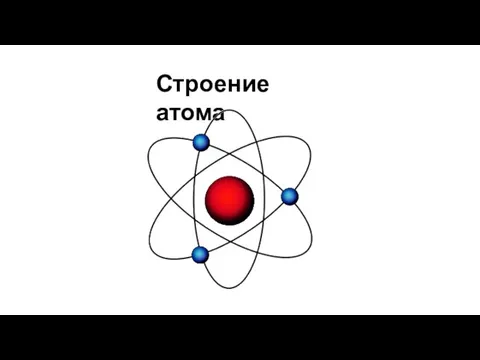
- 2. Строение атома
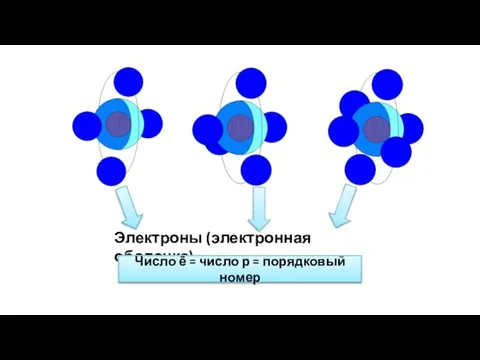
- 3. Электроны (электронная оболочка) Число ē = число р = порядковый номер
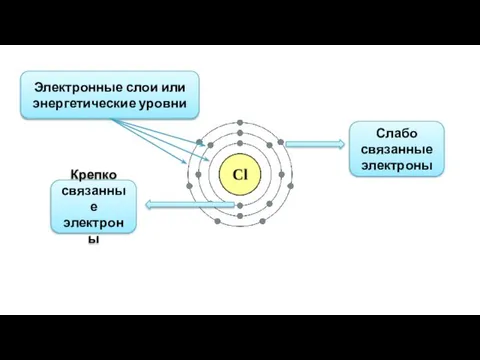
- 4. Слабо связанные электроны Крепко связанные электроны Электронные слои или энергетические уровни
- 5. Число энергетических уровней = номер периода N + 7 2 5
- 6. Максимальное число электронов на энергетическом уровне 2 n2 n – номер периода 1 энергетический уровень: 2
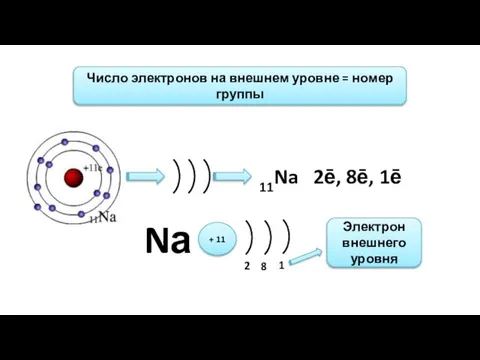
- 7. Число электронов на внешнем уровне = номер группы 11Na 2ē, 8ē, 1ē Nа + 11 2
- 8. Электронное облако, или орбиталь – пространство вокруг ядра, где наиболее вероятно нахождение данного электрона Электронное облако
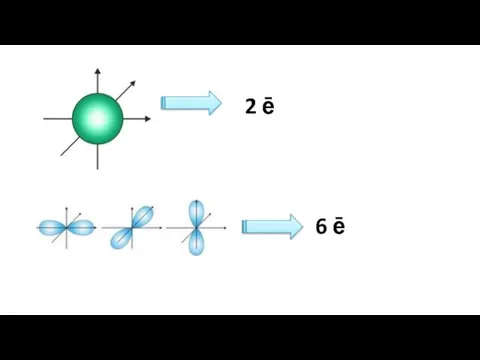
- 9. 2 ē 6 ē
- 10. s2 или p6 Электронная формула атома Число электронов Орбитали 1s22s22p3
- 12. Скачать презентацию




 Презентация на тему Великие учёные, внёсшие значительный вклад в развитие химии
Презентация на тему Великие учёные, внёсшие значительный вклад в развитие химии  Первоначальные химические понятия
Первоначальные химические понятия Алкены (этиленовые углеводороды)
Алкены (этиленовые углеводороды) Презентация на тему Микроэлементы: Хром, Йод, Фтор
Презентация на тему Микроэлементы: Хром, Йод, Фтор 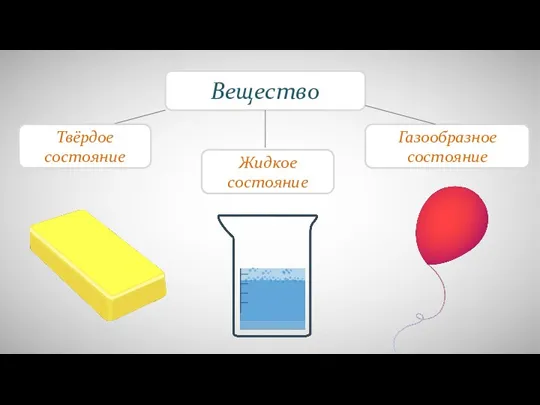 Различия в молекулярном строении газов, жидкостей и твердых тел
Различия в молекулярном строении газов, жидкостей и твердых тел Stereoselective total syntheses of guanacastepenes N and O
Stereoselective total syntheses of guanacastepenes N and O Способы защиты химического оборудования от коррозии
Способы защиты химического оборудования от коррозии Электроны в кристаллах. Квантовая теория свободных электронов в металлах
Электроны в кристаллах. Квантовая теория свободных электронов в металлах Презентация на тему Химические Недотроги
Презентация на тему Химические Недотроги  Презентация на тему Вещества в твоей жизни
Презентация на тему Вещества в твоей жизни  Соли азотной кислоты – нитраты. 9 класс
Соли азотной кислоты – нитраты. 9 класс Карбоновые кислоты. Д.И. Менделеев
Карбоновые кислоты. Д.И. Менделеев Презентация на тему Классификация органических веществ
Презентация на тему Классификация органических веществ  Жаңа синтетикалық есірткілер
Жаңа синтетикалық есірткілер физические и химические явления
физические и химические явления Металлы
Металлы Презентация по Химии "Фиолетовый проказник"
Презентация по Химии "Фиолетовый проказник"  Пористые стекла
Пористые стекла Металлы и их соединения
Металлы и их соединения Карбид кремния
Карбид кремния Комплексные соединения
Комплексные соединения Вольтамперометрия. Полярография постоянного тока. Лекция 3 (ФХМА)
Вольтамперометрия. Полярография постоянного тока. Лекция 3 (ФХМА) Сутек өндірісінің болашақ технологиясы - фотокатализ
Сутек өндірісінің болашақ технологиясы - фотокатализ Основания и их свойства
Основания и их свойства Движение молекул
Движение молекул Органическая химия
Органическая химия Разработка методики расчета фазового равновесия при длительном хранении СПГ
Разработка методики расчета фазового равновесия при длительном хранении СПГ Галогены
Галогены