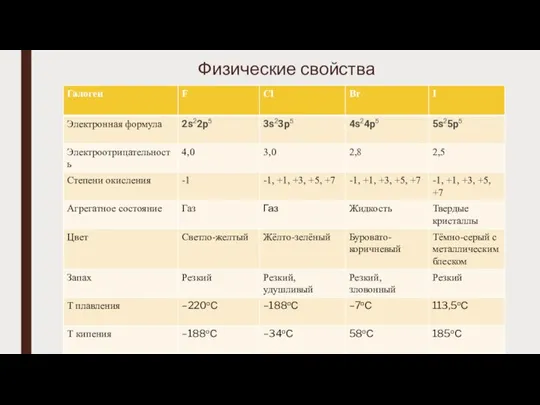
Слайд 4Химические свойства
Взаимодействие с ксеноном
2F2 + Xe = XeF4.
Взаимодействие с металлами
2М + nHal2

= 2MHaln.
Взаимодействие с водородом.
Н2 + Hal2 = 2НHal.
Слайд 5Взаимодействие с неметаллами.
2P + 3Cl2 = 2PCl3;
Si + 2F2 = SiF4.
Взаимодействие

с водой
F2 + H2O = 2HF + O или
3F2 + 3H2O = OF2 + 4HF + H2O2;
Hal + H2O = HHal + HHalO.
Взаимодействие со щелочами
Cl2 + KOH = KClO + KCl (на холоде);
3Cl2 + 6KOH = KClO3 + 5KCl + 3Н2О (при нагревании).
Слайд 6Взаимодействие с сероводородом
H2S + Br2 = S + 2HBr.
Реакция замещения водорода в

предельных углеводородах:
CH4 + Cl2 = CH3Cl + HCl.
Реакция присоединения к непредельным углеводородам:
C2H4 + Cl2 = C2H4Cl2.
Взаимное замещение галогенов2KI + Br2 = 2KBr+ I2;
2HBr + Cl2 = 2HCl + Br2.




 Анилин (амидобензол, аминобензол, фениламин)
Анилин (амидобензол, аминобензол, фениламин) Уравнение состояния
Уравнение состояния от греч. Hydro –вода, Lysis – разложение, распад Гидролиз – это реакция обменного разложения веществ водой
от греч. Hydro –вода, Lysis – разложение, распад Гидролиз – это реакция обменного разложения веществ водой Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс
Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс Органическая химия
Органическая химия Химия – наука о веществах. Вычисления по химическим формулам. Тема 1
Химия – наука о веществах. Вычисления по химическим формулам. Тема 1 Классификация химических элементов
Классификация химических элементов Горные породы
Горные породы Chemické reakcie
Chemické reakcie Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Долговечность пластмасс
Долговечность пластмасс Основания. Состав оснований
Основания. Состав оснований Изменения, происходящие с веществами Урок химии 8 класс Учитель химии МОУ «СОШ №7» г. Балаково Саратовская обл.
Изменения, происходящие с веществами Урок химии 8 класс Учитель химии МОУ «СОШ №7» г. Балаково Саратовская обл. Получение функциональных плёнок на основе TiO2
Получение функциональных плёнок на основе TiO2 Тема: Неметаллы
Тема: Неметаллы Пробоотбор и пробоподготовка
Пробоотбор и пробоподготовка Вода и классы химических веществ
Вода и классы химических веществ Металлы
Металлы Céramiques lesquelles choisi ?
Céramiques lesquelles choisi ? Массовые доли растворенного вещества
Массовые доли растворенного вещества Ионная хроматография
Ионная хроматография Свойства растворов и их взаимодействие с газовой фазой
Свойства растворов и их взаимодействие с газовой фазой Презентация на тему Жидкие кристаллы
Презентация на тему Жидкие кристаллы  Окислительно-восстановительные реакции (ОВР). Лекция 1
Окислительно-восстановительные реакции (ОВР). Лекция 1 Применение неорганических соединений в пищевой промышленности
Применение неорганических соединений в пищевой промышленности Катализаторы и катализ
Катализаторы и катализ Сталь 12Х18Н10Т
Сталь 12Х18Н10Т Искусственные полимеры
Искусственные полимеры