Содержание
- 2. ( Семейство щелочных металлов ) ЦЕЛЬ: - создать условия для применения полученных знаний в новых условиях
- 3. Развивающие: - развитие способности строить аналогии, обобщать, систематизировать и делать выводы - Формирование умения наблюдать, разбивать
- 4. ХОД УРОКА I ОРГАНИЗАЦИОННЫЙ МОМЕНТ Приветствие. Проверка готовности к уроку. Определение отсутствующих. II Мотивация и целеполагание
- 5. ВЫВОДЫ: Щелочные металлы –восстановители С.О, +1 ; 0 Если щелочные металлы так похожи друг на друга,
- 6. 2. Щелочные металлы - простые вещества а) Металлическая кристаллическая решетка, металлическая связь ( модели кристаллических решеток
- 7. СХЕМА ВЗАИМОДЕЙСТВИЯ МЕТАЛЛОВ с простыми веществами со сложными веществами М М Работа с учебником ( с
- 8. ВОПРОСЫ: -Дополните схему формулами и названиями, используя учебник параграф 11 - Найдите особенное свойство щелочных металлов.
- 9. 3. СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ Задание Дан текст в котором спрятаны формулы оснований ( щелочей) H2RbOHBa(OH)2NaCO2MgBaKOHSO AlPO4HSOLiOHNOCa(OH)2NOKSP2O5
- 10. ЛАБОРАТОРНАЯ РАБОТА ВЗАИМОДЕЙСТВИЕ ГИДРОКСИДА НАТРИЯ С СЕРНОЙ КИСЛОТОЙ ТЕХНИКА БЕЗОПАСНОСТИ ФИПИ 2012 год стр. 25 А13
- 12. Скачать презентацию









 Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Смеси и взвеси веществ. Простейшие операции с веществом
Смеси и взвеси веществ. Простейшие операции с веществом Введение в химию. Вещества. Факультатив по химии для учащихся 7 класса
Введение в химию. Вещества. Факультатив по химии для учащихся 7 класса Презентация на тему Окислительно-восстановительные реакции: общие сведения
Презентация на тему Окислительно-восстановительные реакции: общие сведения  Изомерия
Изомерия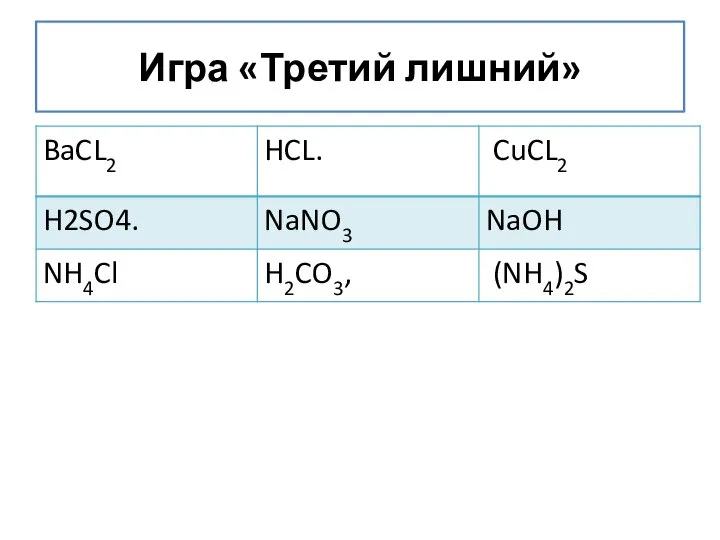 Аммиак. Соли аммония
Аммиак. Соли аммония Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства
Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства Незаменимая уксусная кислота
Незаменимая уксусная кислота Презентация на тему Растворы
Презентация на тему Растворы  Презентация на тему Производство чугуна и стали
Презентация на тему Производство чугуна и стали  Арены. Бензол
Арены. Бензол Конструирование макромолекул методом ATRP
Конструирование макромолекул методом ATRP Основания
Основания Строение вещества
Строение вещества Понятие электродного потенциала и методы его измерения
Понятие электродного потенциала и методы его измерения Выход продуктов пиролиза бензина
Выход продуктов пиролиза бензина Коррозия металлов, сплавов
Коррозия металлов, сплавов Алкены. Непредельные углеводороды
Алкены. Непредельные углеводороды Терпеноиды. Эфирные масла
Терпеноиды. Эфирные масла Квантовая химия
Квантовая химия Аморфные и кристаллические вещества
Аморфные и кристаллические вещества Первые попытки классификации химических элементов
Первые попытки классификации химических элементов Презентация на тему Кристаллическая решетка
Презентация на тему Кристаллическая решетка  _ _Производство цветных металлов. Методы плавки алюминия_
_ _Производство цветных металлов. Методы плавки алюминия_ Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Кислота. Карбоновые кислоты
Кислота. Карбоновые кислоты Язык химии. Знаки химических элементов
Язык химии. Знаки химических элементов Вода и классы химических веществ
Вода и классы химических веществ