Содержание
- 2. Лекция №2 Строение органических молекул 1. Введение 2. Строение атома 3. Проблема химической связи Электроотрицательность; Ковалентная
- 3. Фридрих Август Кекуле Алексадр Михайлович Бутлеров Арчибальд Скотт Купер Теория валентности; четырех- валентность атома углерода 1857г.
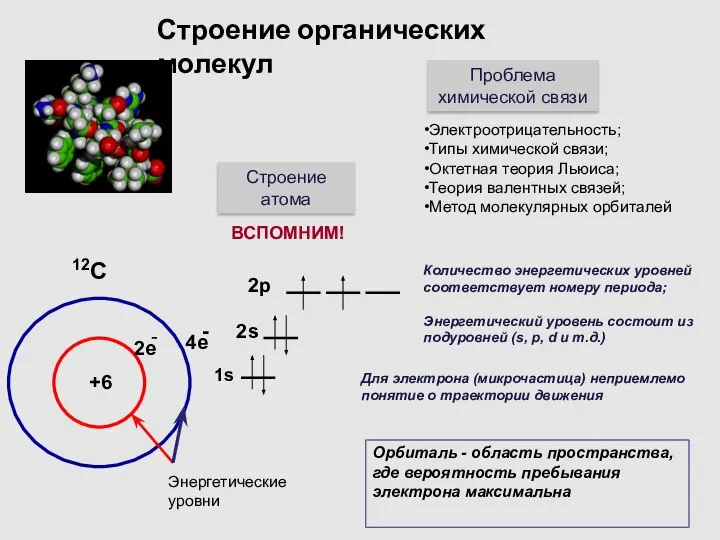
- 4. Строение органических молекул Строение атома Проблема химической связи Электроотрицательность; Типы химической связи; Октетная теория Льюиса; Теория
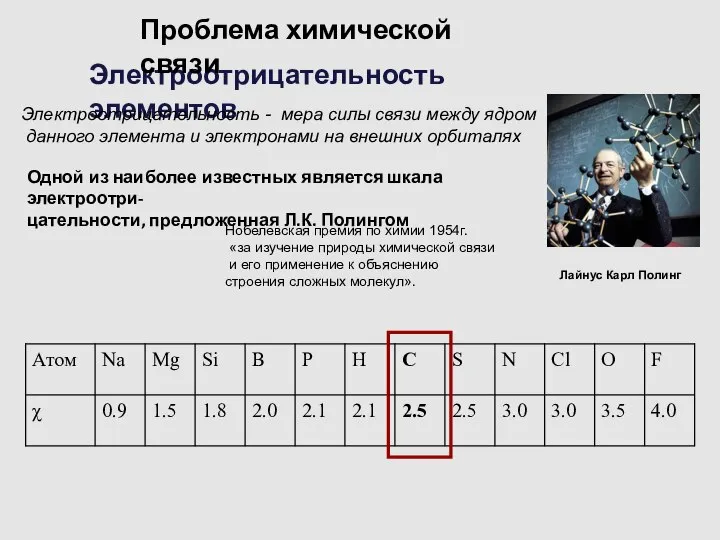
- 5. Электроотрицательность элементов Электроотрицательность - мера силы связи между ядром данного элемента и электронами на внешних орбиталях
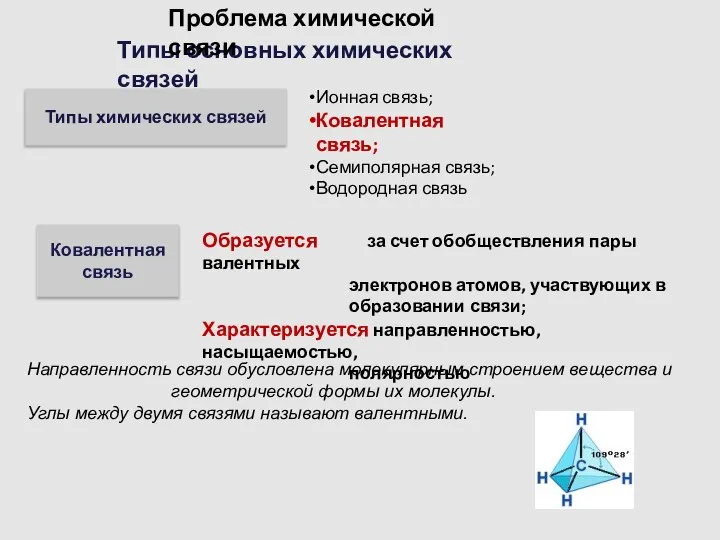
- 6. Типы основных химических связей Проблема химической связи Типы химических связей Ионная связь; Ковалентная связь; Семиполярная связь;
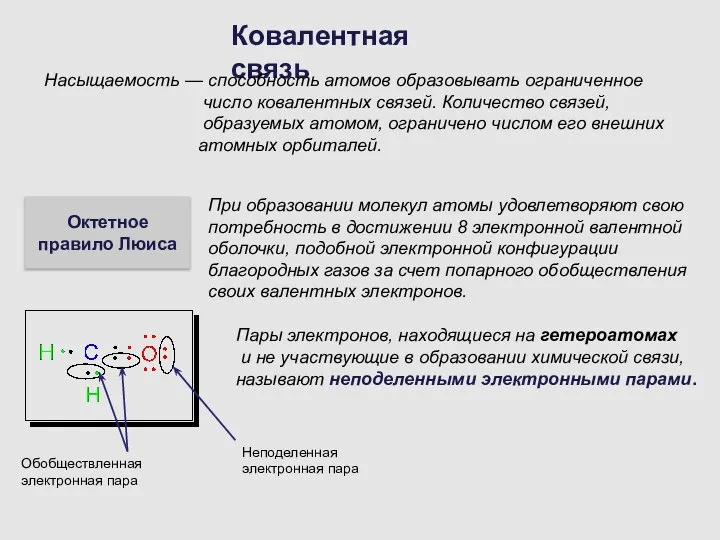
- 7. Ковалентная связь Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено
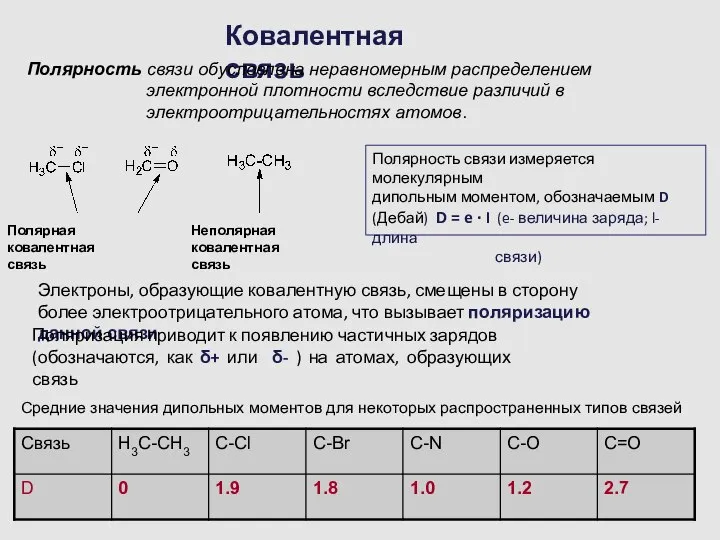
- 8. Ковалентная связь Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. Полярная ковалентная
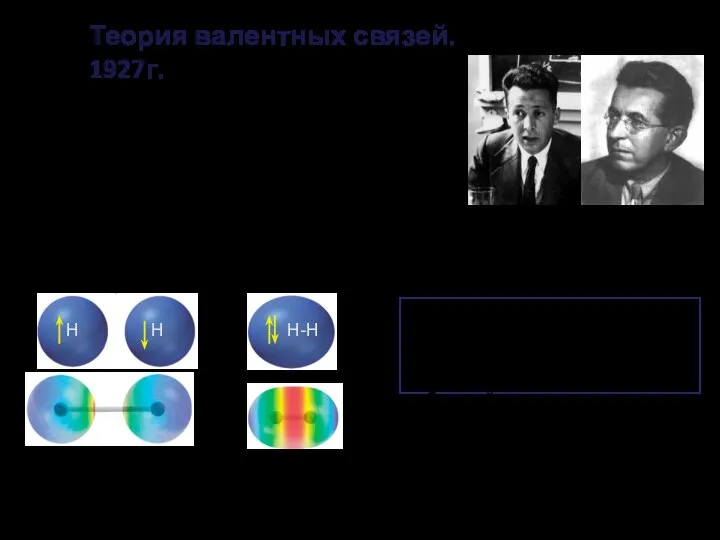
- 9. Вальтер Генрих Гейтлер Фриц Лондон Теория валентных связей. 1927г. Каждая пара атомов в молекуле удерживается вместе
- 10. Концепция гибридизации атомных орбиталей, 1931г. Л. Полинг Виды гибридизации sp3 — гибридизация (алканы); sp2 — гибридизация
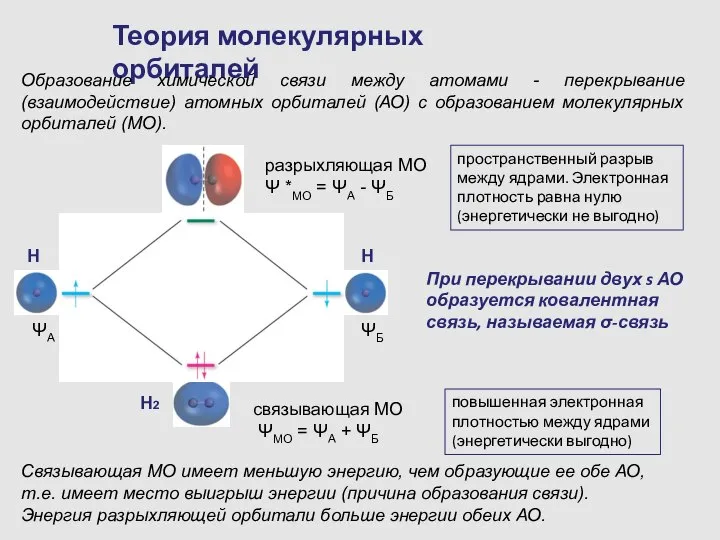
- 11. Теория молекулярных орбиталей Образование химической связи между атомами - перекрывание (взаимодействие) атомных орбиталей (АО) с образованием
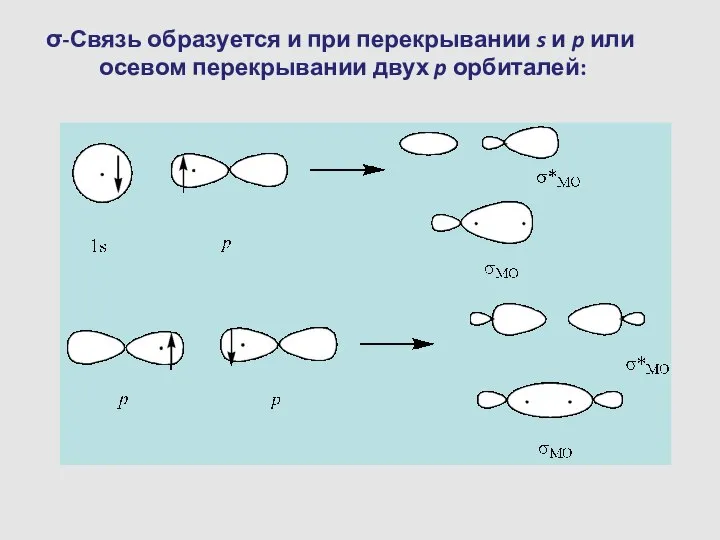
- 12. σ-Связь образуется и при перекрывании s и p или осевом перекрывании двух p орбиталей:
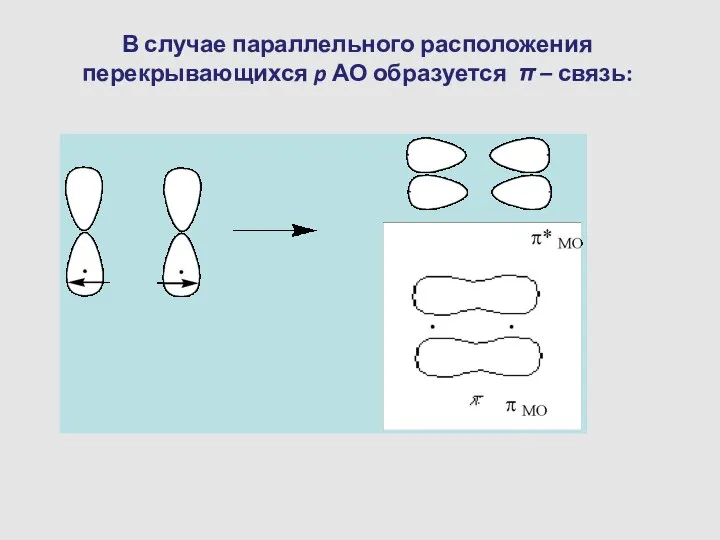
- 13. В случае параллельного расположения перекрывающихся p АО образуется π – связь:
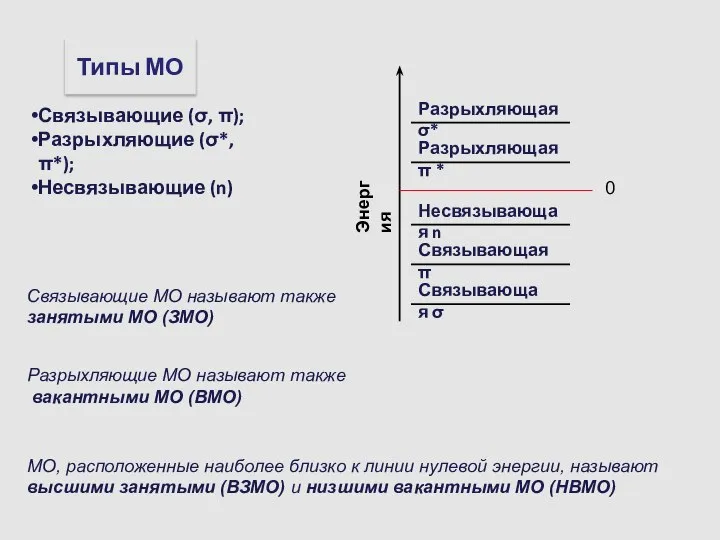
- 14. Связывающие МО называют также занятыми МО (ЗМО) Разрыхляющие МО называют также вакантными МО (ВМО) МО, расположенные
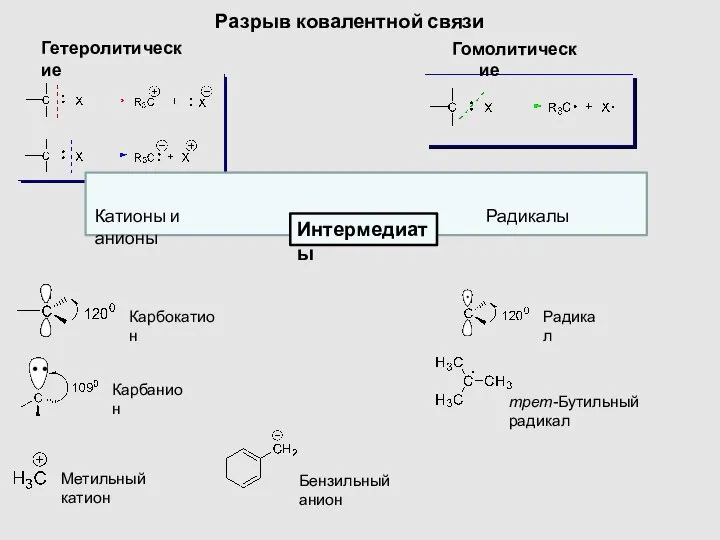
- 15. Разрыв ковалентной связи Гомолитические Гетеролитические Карбокатион Карбанион Метильный катион Радикал Бензильный анион трет-Бутильный радикал Катионы и
- 17. Скачать презентацию



 Ароматические углеводороды. Бензол
Ароматические углеводороды. Бензол Условия, замедляющие выход водорастворимых питательных веществ из удобрений на примере аммофоса
Условия, замедляющие выход водорастворимых питательных веществ из удобрений на примере аммофоса Химическое равновесие
Химическое равновесие Альдегиды. Состав. Строение. Свойства. Применение
Альдегиды. Состав. Строение. Свойства. Применение Общая химическая технология. Определение размеров реакторов. Практическое занятие 8
Общая химическая технология. Определение размеров реакторов. Практическое занятие 8 Сeквенирование нуклеиновых кислот
Сeквенирование нуклеиновых кислот Презентация на тему Предельные углеводороды
Презентация на тему Предельные углеводороды  Химическая школа ДПИ НГТУ
Химическая школа ДПИ НГТУ Соединения Ca и Mg, представителей элементов II группы главной подгруппы
Соединения Ca и Mg, представителей элементов II группы главной подгруппы Решение задач
Решение задач Хлор
Хлор Скорость химической реакции
Скорость химической реакции Закон сохранения массы веществ. Признаки химических реакций
Закон сохранения массы веществ. Признаки химических реакций Кислородсодержащие органические вещества. Тест
Кислородсодержащие органические вещества. Тест Арены – ароматические углеводороды
Арены – ароматические углеводороды Электролитическая диссоциация
Электролитическая диссоциация Карбоновые кислоты и их производные. (Лекция 11)
Карбоновые кислоты и их производные. (Лекция 11) Основы химической кинетики
Основы химической кинетики Презентация на тему Применение жиров
Презентация на тему Применение жиров  Магний
Магний Алкины
Алкины Вторичная переработка нефти. Крекинг
Вторичная переработка нефти. Крекинг Неорганосфера. Неметаллы
Неорганосфера. Неметаллы Азотная кислота и ее соли. Специфические свойства азотной кислоты
Азотная кислота и ее соли. Специфические свойства азотной кислоты Неорганические окислители и восстановители
Неорганические окислители и восстановители Презентация на тему Химические средства гигиены и косметика
Презентация на тему Химические средства гигиены и косметика  Углеводы
Углеводы Презентация на тему Всё о кремнии
Презентация на тему Всё о кремнии