Содержание
- 2. Примеры природных окислительно-восстановительных процессов Колосс Родосский – статуя из железа и бронзы
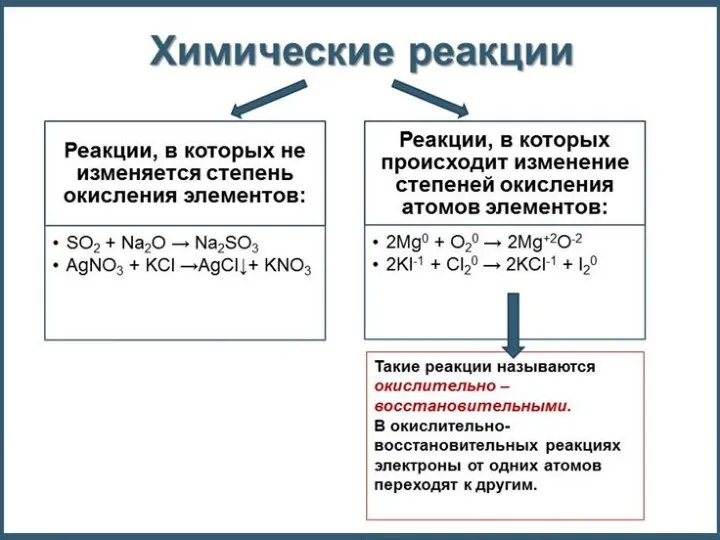
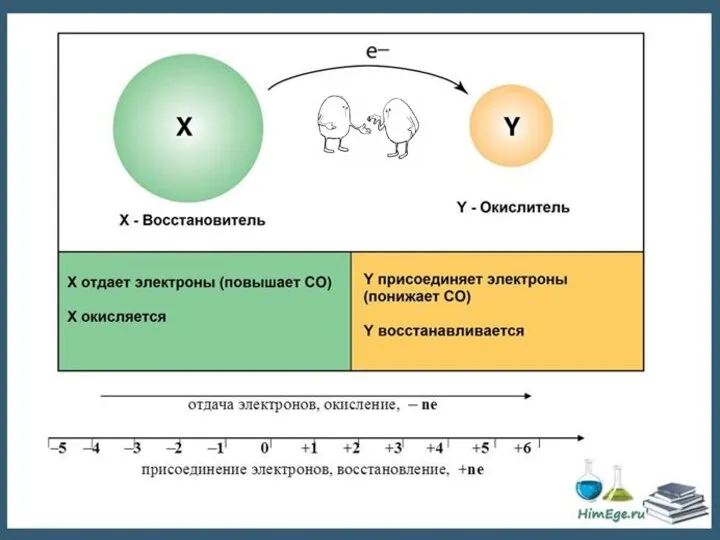
- 4. Степень окисления – число электронов, отданных или принятых атомом при образовании химической связи. Принятые электроны показывают
- 5. Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что
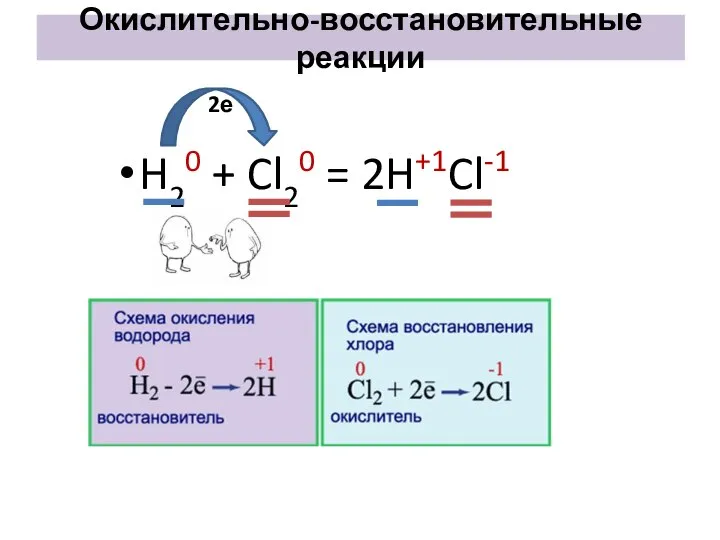
- 6. H20 + Cl20 = 2H+1Cl-1 Окислительно-восстановительные реакции 2е
- 7. Правила определения степени окисления 1.У свободных атомов и у простых веществ СО равна 0. O20, Cl20,
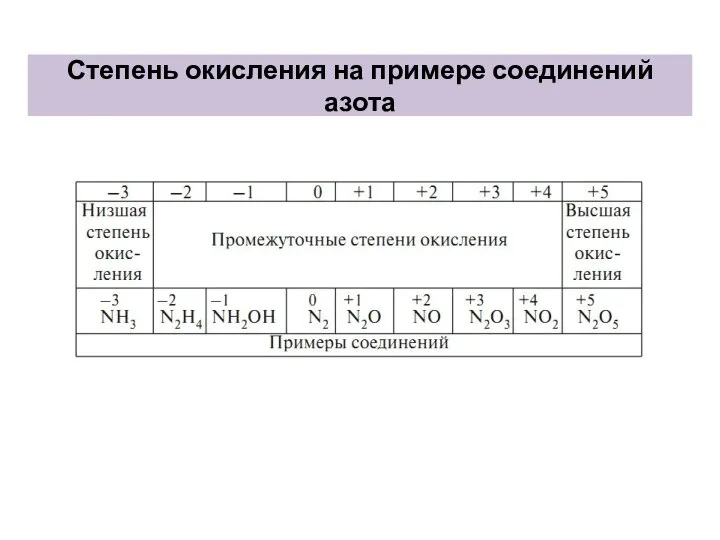
- 8. Степень окисления на примере соединений азота
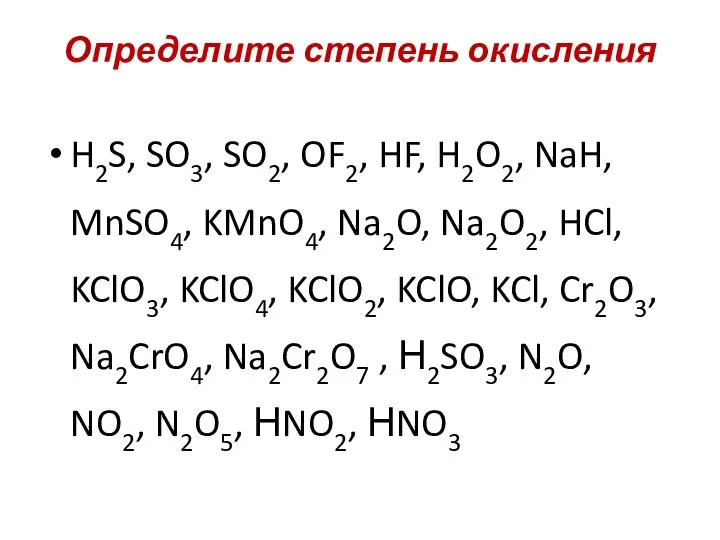
- 9. Определите степень окисления H2S, SO3, SO2, OF2, HF, H2O2, NaH, MnSO4, KMnO4, Na2O, Na2O2, HCl, KClO3,
- 10. Определите степени окисления атомов в соединениях Вариант 1: а) PH3, P2O3, H3PO4, Mg3P2 , Р4 б)
- 12. Окислительно-восстановительные реакции H20 + Cl20 = 2H+1Cl-1
- 15. Реакция, уравнение которой 4NH3 +5O 2 → 4NO + 6H2O соответствует схема превращения азота 1) N+3
- 16. Установите соответствие между изменением степени окисления атома серы и схемой превращения вещества. СХЕМА ПРЕВРАЩЕНИЙ A) H2S
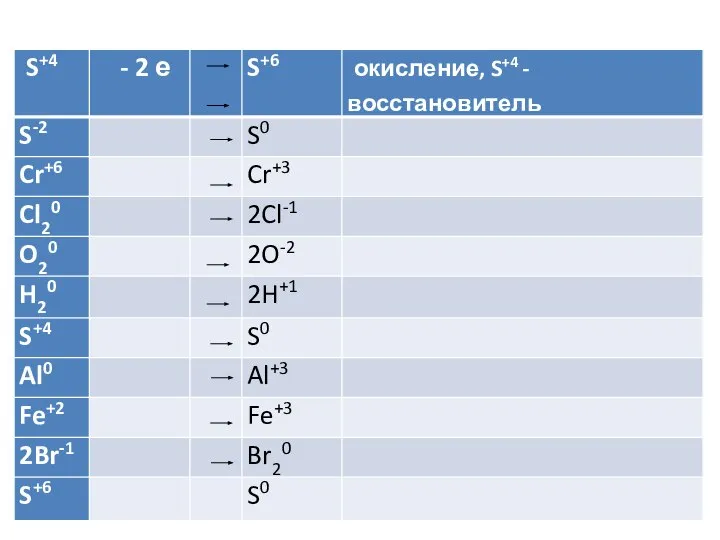
- 17. Расстановка коэффициентов в уравнениях реакций методом электронного баланса Метод электронного баланса
- 18. KClO3 + P → KCl + P2O5 K+1Cl+5O-23 + P0 → K+1Cl-1 + P+52O-25 2. Для
- 19. KClO3 + P → KCl + P2O5 K+1Cl+5O-23 + P0 → K+1Cl-1 + P+52O-25 Cl+5 +
- 20. МЕТОД ЭЛЕКТРОННОГО БАЛАНСА Записать схему реакции Определить СО элементов Определить число отданных и принятых электронов Составить
- 22. Скачать презентацию













 Применение алкенов
Применение алкенов Строение электронных оболочек атомов элементов малых периодов
Строение электронных оболочек атомов элементов малых периодов Prezentatsia1_1 (1)
Prezentatsia1_1 (1) Углеводы
Углеводы Метил-трет-бутиловый эфир
Метил-трет-бутиловый эфир Азот
Азот Презентация на тему Молярный объем
Презентация на тему Молярный объем  Простые вещества - металлы. 8 класс
Простые вещества - металлы. 8 класс Пропиновые кислоты
Пропиновые кислоты ОВР химияПрезентация
ОВР химияПрезентация Ионная связь. Вещества ионного ( немолекулярного) строения
Ионная связь. Вещества ионного ( немолекулярного) строения Презентация на тему Витамин C
Презентация на тему Витамин C  Железо и его соединения
Железо и его соединения Амфотерность. Амфотерные соединения
Амфотерность. Амфотерные соединения Подготовка к экзамену. Органическая химия
Подготовка к экзамену. Органическая химия Структура периодической таблицы элементов
Структура периодической таблицы элементов Азот. Нахождение в природе
Азот. Нахождение в природе Rozcieńczanie i zatężanie roztworów
Rozcieńczanie i zatężanie roztworów Арены. Бензол
Арены. Бензол Тяжелая вода
Тяжелая вода Генетические ряды неорганических соединений
Генетические ряды неорганических соединений Метаболизм азота
Метаболизм азота История создания периодической таблицы
История создания периодической таблицы Материаловедение. Деформация и разрушение материалов. (Тема 4)
Материаловедение. Деформация и разрушение материалов. (Тема 4) Взаимодействие элементов-неметаллов между собой. 8 класс
Взаимодействие элементов-неметаллов между собой. 8 класс Подготовила Ковальчук О.М. учитель химии высшей квалификационной категории
Подготовила Ковальчук О.М. учитель химии высшей квалификационной категории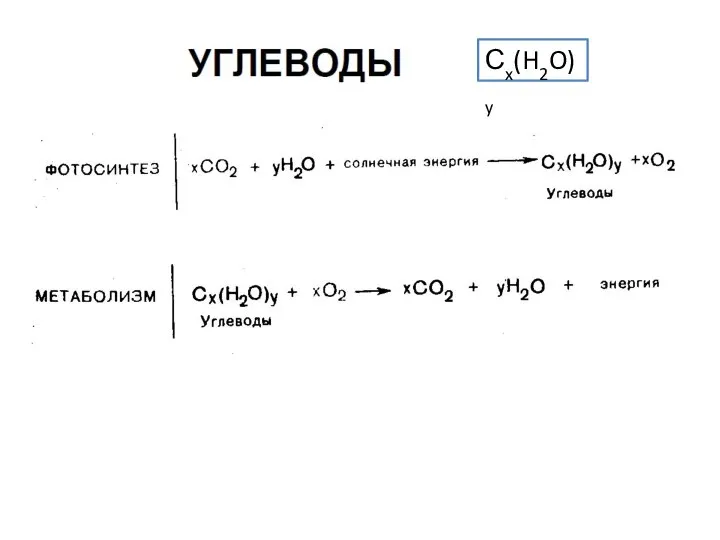 Углеводы. Классификация, cтроение
Углеводы. Классификация, cтроение Алкины. Строение, изомерия, физические свойства, получение. Химические свойства, применение ацетилена
Алкины. Строение, изомерия, физические свойства, получение. Химические свойства, применение ацетилена