Слайд 2A+B ->C
C -> A+B
AB+C -> CB+A
AB+CD -> AD+ CB
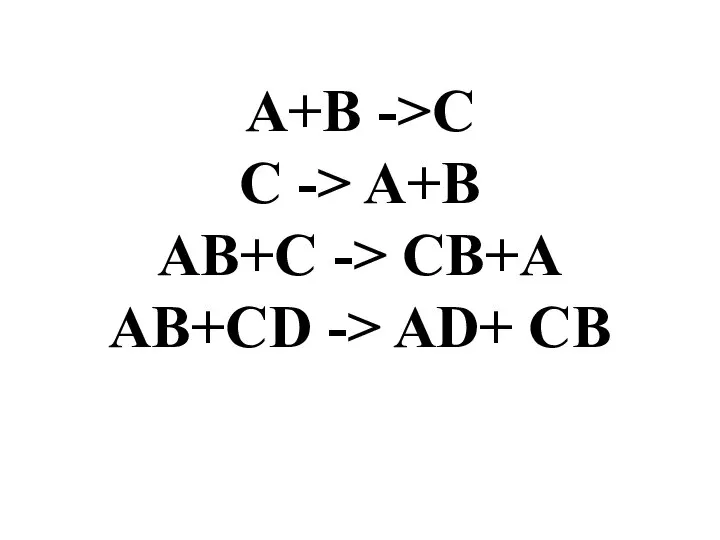
Слайд 3Практическое занятие: Решение задач. Классификация химических реакций

Слайд 4Цели урока.
Образовательная: обобщить и закрепить знания и умения обучающихся по теме «Классификация

химических реакций»
Слайд 5Самостоятельная работа
по вариантам

Слайд 91. Определить типы химических реакций:
- изменению числа и состава реагентов и продуктов реакции

-по тепловому эффекту химической реакции;
- по участию катализатора;
- по обратимости реакции;
- по изменению степеней окисления элементов соединений в реакции;
- по агрегатному состоянию
Слайд 102. Расставить степени окисления элементов в соединениях:

Слайд 113. Составить уравнения диссоциации электролитов:

Слайд 12-Физ. минутка:
Вы отвечаете на вопрос – является ли реакция окислительно –восстановительной?

При ответе «Да» - встаете, справа от стула и поднимаете руки вверх три раза
При ответе «Нет» -встаете, слева от стула и поворачиваете головой три раза влево-вправо
Слайд 14Cu + 4HNO 3 → Cu(NO 3) 2 + 2NO 2 +

2H 2O
Слайд 162KI + Pb(NO 3) 2 → 2KNO 3 + PbI 2↓

Слайд 174.Составить уравнения реакций в ионно – молекулярном виде между:
а) карбонатом натрия и

хлоридом кальция;
б) серной кислотой и нитратом бария;
в) хлоридом бария и сульфатом меди (II) .
Слайд 185. Выполнение задания устно:
К каким типам можно отнести реакции:

Слайд 201. C + O2 = CO2 + 412 кДж , реакция соединения,

ОВ, экзотермическая, некаталитическая, гомогенная, необратимая
2. CaO + H2O → Ca(OH)2 , реакция соединения, неОВ, экзотермическая, некаталитическая, гетерогенная, необратимая
Слайд 217. Домашнее задание: задание в тетради: расставить коэффициенты при помощи электронного баланса, указать

окислитель и восстановитель реакции: FeCl3 + H2S = FeCl2 + S + HCl
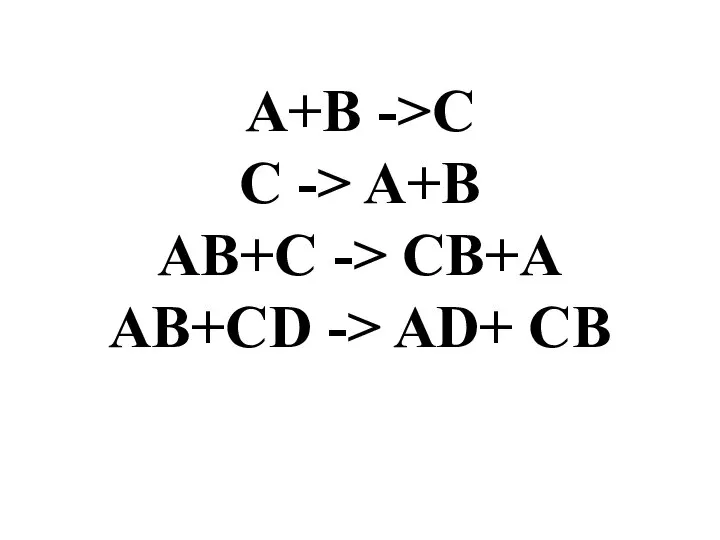










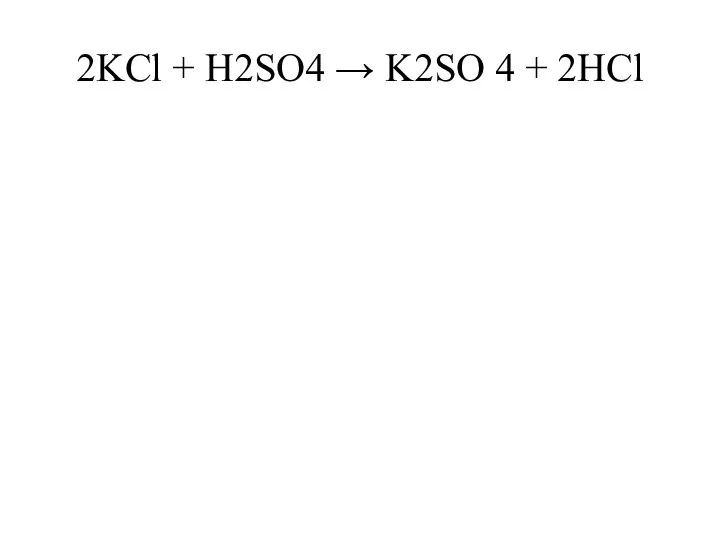









 Які існують способи розділення сумішей?
Які існують способи розділення сумішей? Производные углеводородов
Производные углеводородов Презентация по Химии "Металлы в организме человека"
Презентация по Химии "Металлы в организме человека"  Циклоалканы (циклопарафины)
Циклоалканы (циклопарафины) Физико-химические методы анализа. Лекция № 1
Физико-химические методы анализа. Лекция № 1 Роль Хеуорса, Фишера, Лемье в изучении структуры углеводов
Роль Хеуорса, Фишера, Лемье в изучении структуры углеводов Составление химических формул по валентности
Составление химических формул по валентности Периодический закон, 9 класс (1)
Периодический закон, 9 класс (1) ЛК 2_окислительно-восстановительные процессы
ЛК 2_окислительно-восстановительные процессы Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Практикум по химии и технологии нефти и газа
Практикум по химии и технологии нефти и газа Значение химии в медицине
Значение химии в медицине Кислотно-основное равновесие
Кислотно-основное равновесие Презентация на тему Карбоновые кислоты и их производные
Презентация на тему Карбоновые кислоты и их производные  Химические элементы
Химические элементы Диссоциация оснований, кислот, солей
Диссоциация оснований, кислот, солей Тест по химии
Тест по химии Способы разделение смесей. 7 класс
Способы разделение смесей. 7 класс 9-12 Гидролиз солей -
9-12 Гидролиз солей - Кристаллы. Виды
Кристаллы. Виды Теория электролитической диссоциации
Теория электролитической диссоциации Оценивание эффективности многофункциональной присадки для бензинов
Оценивание эффективности многофункциональной присадки для бензинов Биогеотехнология
Биогеотехнология Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Окислительно-восстаовительные реакции
Окислительно-восстаовительные реакции Галогены - простые вещества
Галогены - простые вещества Презентация на тему Неорганическая химия: подготовка к ГИА
Презентация на тему Неорганическая химия: подготовка к ГИА  Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"
Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"