Содержание
- 2. I. Основания II. Кислоты ПЛАН ЗАНЯТИЯ
- 3. I. Основания Число гидроксильных групп равно валентности металла (Ме).
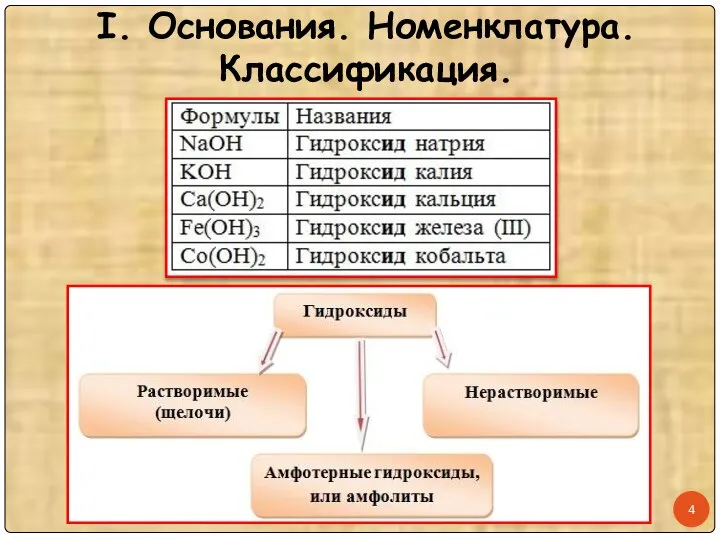
- 4. I. Основания. Номенклатура. Классификация.
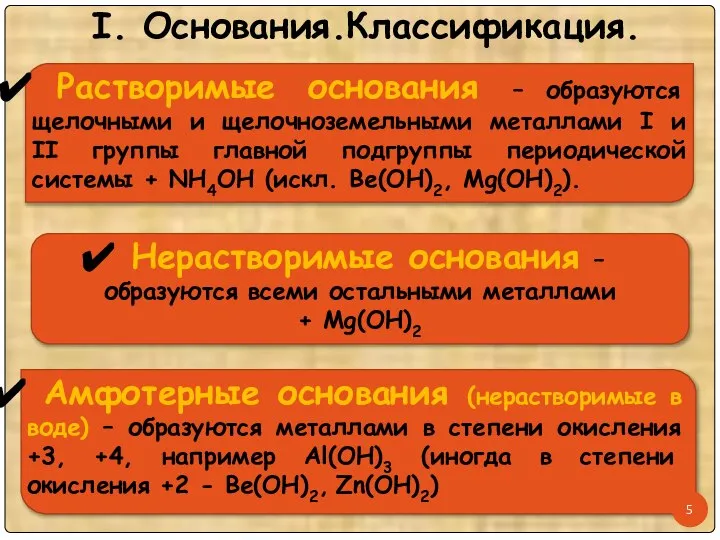
- 5. I. Основания.Классификация.
- 6. I. Основания.Получение. 1. Некоторые щелочи получают электролизом растворов солей: 2NaCl + 2H2O H2 + 2NaOH +
- 7. 4. Общим способом получения амфотерных гидроксидов является действие щелочи на соль соответствующего металла, например: ZnCl2 +
- 8. I. Основания. Физические свойства.
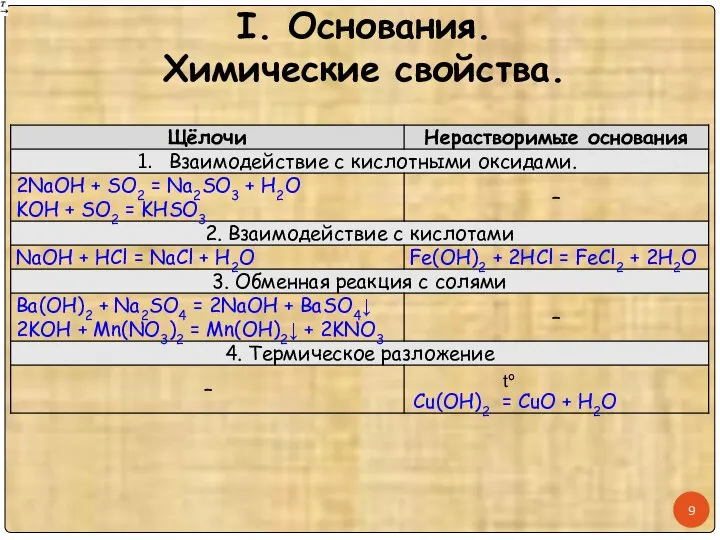
- 9. I. Основания. Химические свойства. tº
- 10. I. Основания. Химические свойства. Амфолиты реагируют с кислотами и щелочами. При этом в кислой среде равновесие
- 11. II. Кислоты Кислоты можно классифицировать в зависимости от: 1) наличия или отсутствия атомов кислорода в формуле
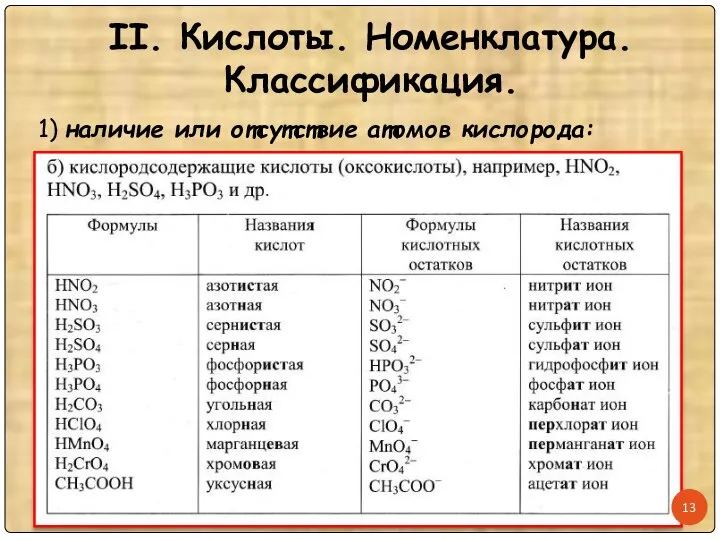
- 12. II. Кислоты. Номенклатура. Классификация. 1) наличие или отсутствие атомов кислорода:
- 13. II. Кислоты. Номенклатура. Классификация. 1) наличие или отсутствие атомов кислорода:
- 14. II. Кислоты. Классификация. 2) число катионов водорода:
- 15. II. Кислоты.Классификация. 2) число катионов водорода: 3) по силе:
- 16. II. Кислоты. Получение. 2. Взаимодействие кислотных оксидов с водой: N2O5+H2O→2HNO3 SO3+H2O→H2SO4 3. Взаимодействие солей с кислотами:
- 17. II. Кислоты. Физические свойства.
- 19. Скачать презентацию












 Презентация на тему Уголь
Презентация на тему Уголь  Полиэтилен-1
Полиэтилен-1 h-m-chniy-zv-yazok-budova-rechovin
h-m-chniy-zv-yazok-budova-rechovin Кислоты. Классификация сложных неорганических веществ
Кислоты. Классификация сложных неорганических веществ Строение и свойства металлов. Материаловедение. Лекция 1
Строение и свойства металлов. Материаловедение. Лекция 1 Водные растворы электролитов
Водные растворы электролитов Викторина Что это?
Викторина Что это? Автомобильные бензины. Свойства топлив
Автомобильные бензины. Свойства топлив Алкины
Алкины Получение аминов
Получение аминов Инструкция по самостоятельной подготовке к ЕГЭ (ЕРЭ) по химии 2022
Инструкция по самостоятельной подготовке к ЕГЭ (ЕРЭ) по химии 2022 Современные представления о строении атома
Современные представления о строении атома Общие способы получения металлов
Общие способы получения металлов Калифорний Cf
Калифорний Cf Гетероциклические соединения. Пятичленные гетероциклы с одним гетероатомом
Гетероциклические соединения. Пятичленные гетероциклы с одним гетероатомом Относительный вклад % буферных систем крови в поддержание в ней протолитического гомеостаза
Относительный вклад % буферных систем крови в поддержание в ней протолитического гомеостаза Классификация органических веществ
Классификация органических веществ Железо
Железо Азотная кислота
Азотная кислота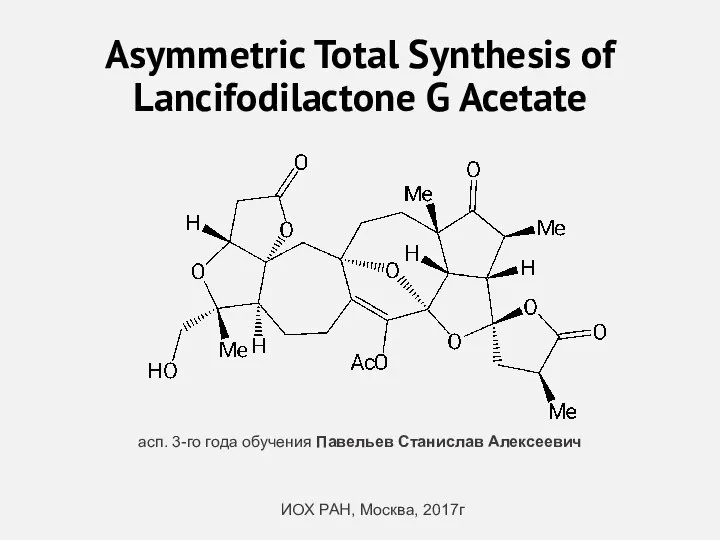 Asymmetric Total Synthesis of Lancifodilactone G Acetate
Asymmetric Total Synthesis of Lancifodilactone G Acetate Амины и анилин
Амины и анилин Адсорбционные материалы. Цеолиты
Адсорбционные материалы. Цеолиты Электролитическая диссоциация
Электролитическая диссоциация Всё о нефти. Часть 5
Всё о нефти. Часть 5 Альдегиды, свойства, получение, применение
Альдегиды, свойства, получение, применение Презентация на тему Химия и здоровье человека (10 класс)
Презентация на тему Химия и здоровье человека (10 класс)  Фуллерены (шары Бакминстера)
Фуллерены (шары Бакминстера) Органическая химия: пищевые добавки
Органическая химия: пищевые добавки