Содержание
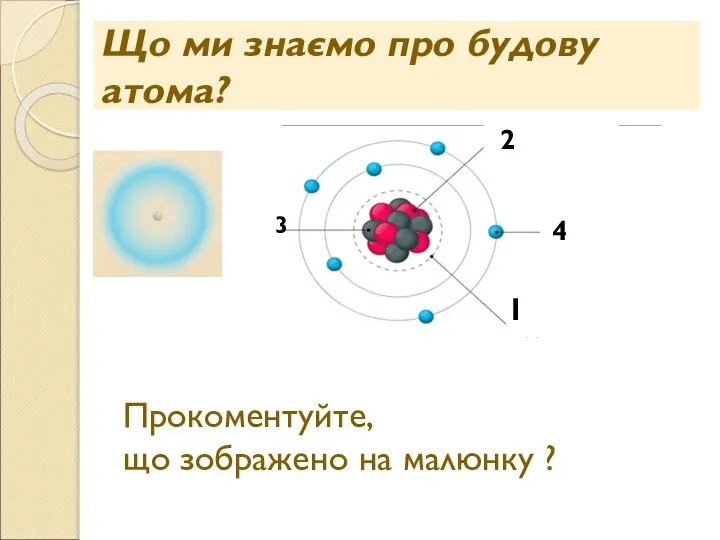
- 2. Що ми знаємо про будову атома? Прокоментуйте, що зображено на малюнку ? 111 1 2 3
- 3. Що ми знаємо про електрон? Заряд і маса електрона В чому полягають особливості руху електрона навколо
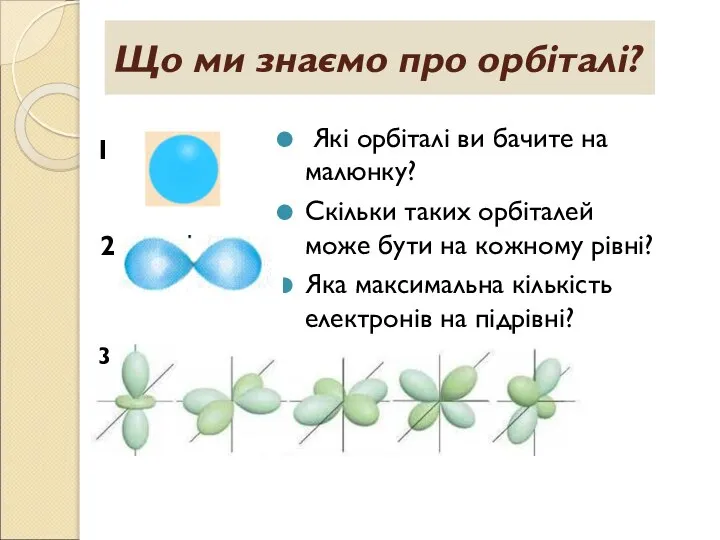
- 4. Що ми знаємо про орбіталі? Які орбіталі ви бачите на малюнку? Скільки таких орбіталей може бути
- 5. Зв’язок між будовою атома та його положенням у періодичній системі
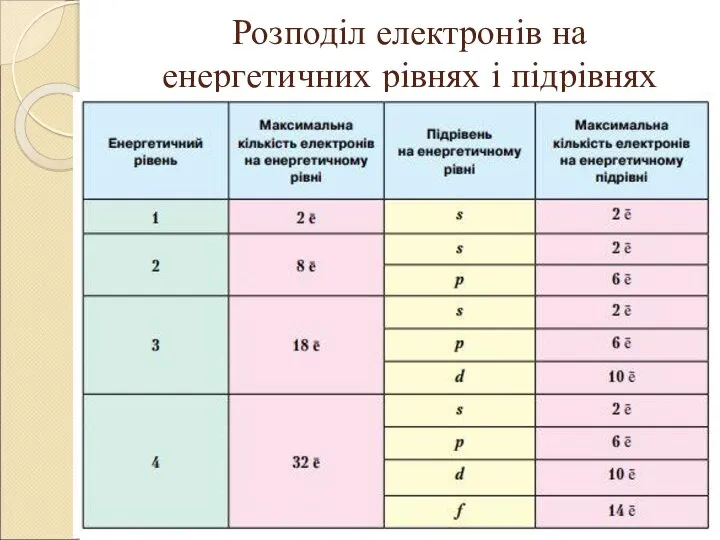
- 6. Розподіл електронів на енергетичних рівнях і підрівнях
- 7. Номер періоду, в якому розміщений хімічний елемент, вказує на кількість енергетичних рівнів (шарів), по яких рухаються
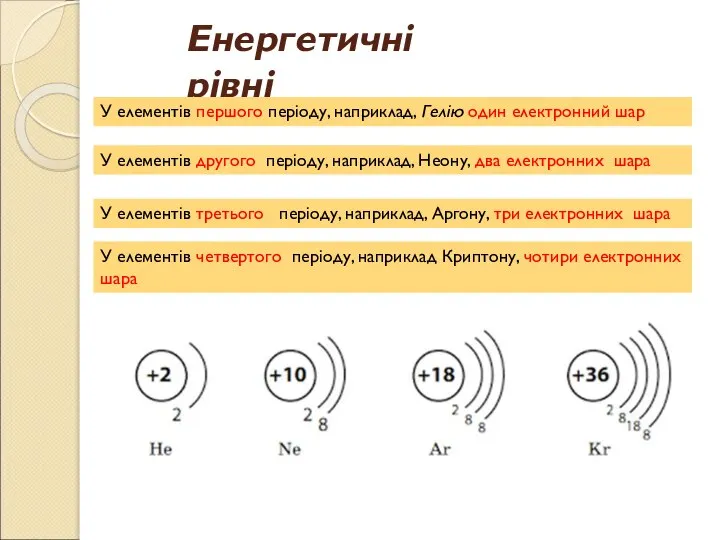
- 8. Енергетичні рівні У елементів першого періоду, наприклад, Гелію один електронний шар У елементів другого періоду, наприклад,
- 9. Енергетичні рівні Прокоментуйте розподіл електронів по енргеничним рівням у атома Натрію Хімічний елемент Натрій розташований в
- 10. Розподіл електронів на енергетичних рівнях На кожному енергетичному рівні може перебувати суворо визначене число електронів. Максимальна
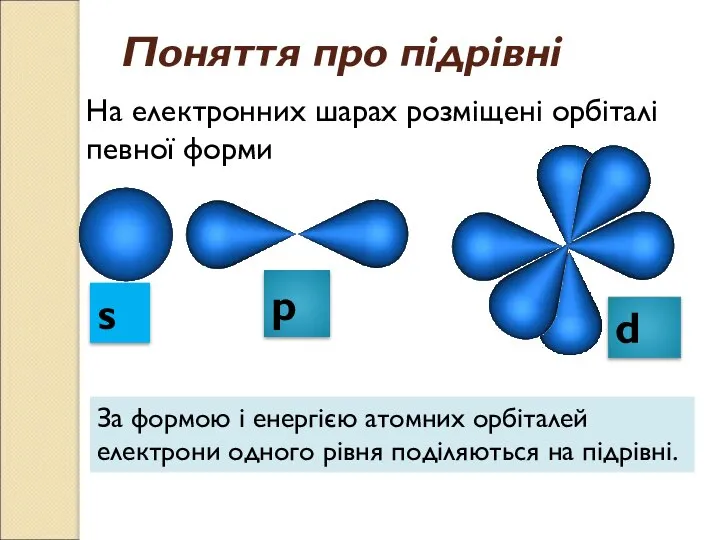
- 11. На електронних шарах розміщені орбіталі певної форми s р d Поняття про підрівні За формою і
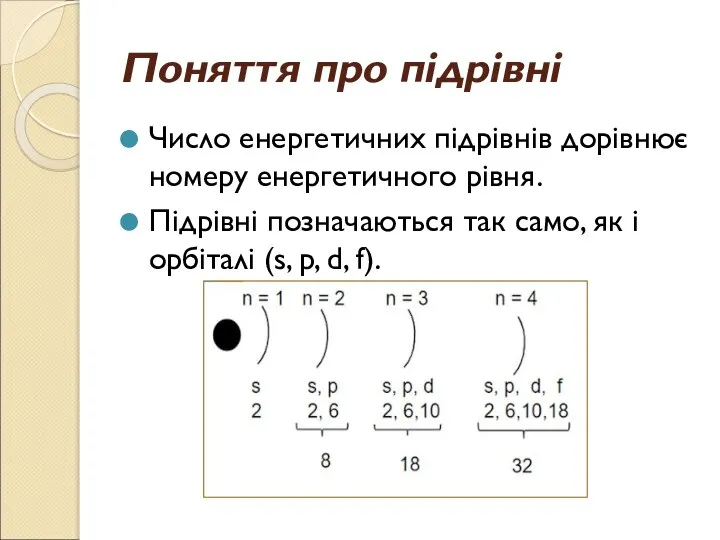
- 12. Поняття про підрівні Число енергетичних підрівнів дорівнює номеру енергетичного рівня. Підрівні позначаються так само, як і
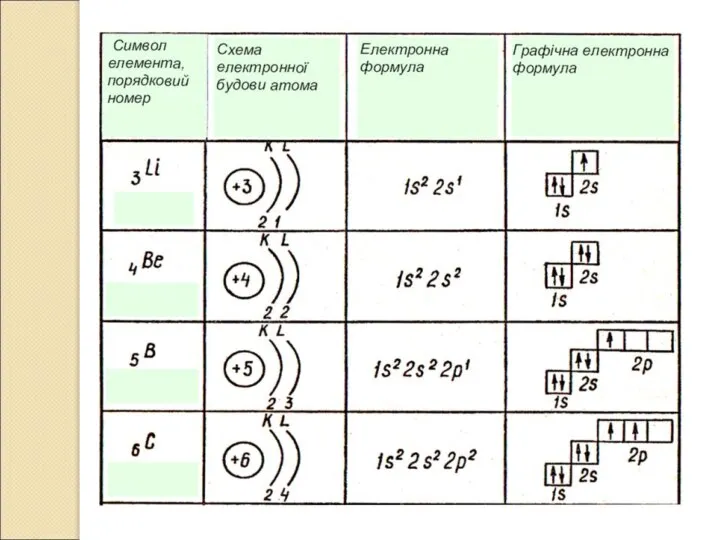
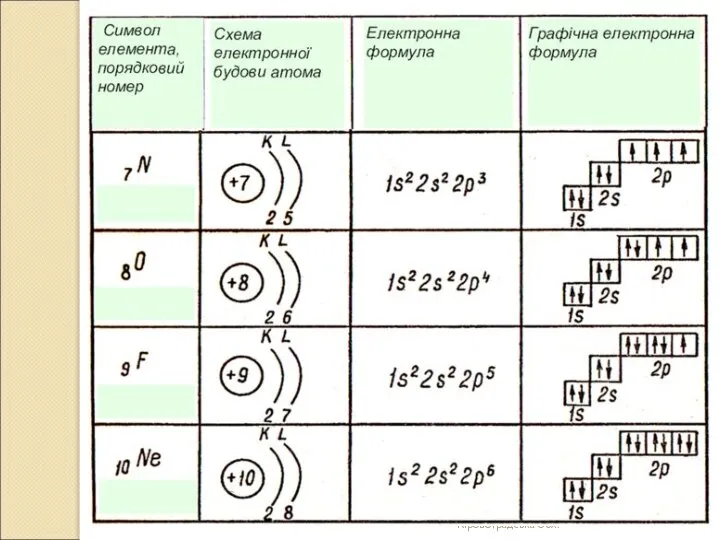
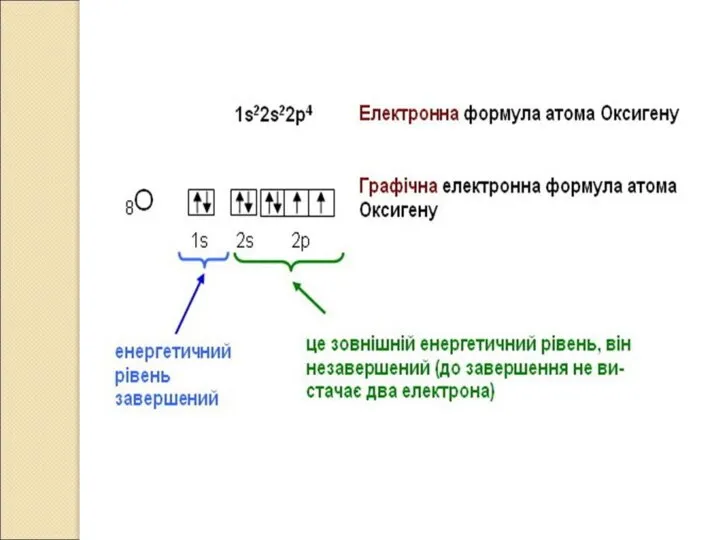
- 13. Електронна формула Електронна формула атома – це запис розподілу електронів в атомі за допомогою коефіцієнтів, якими
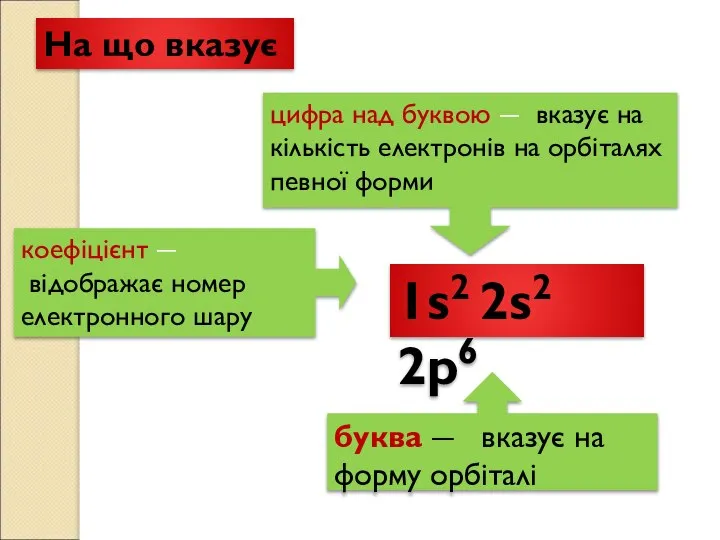
- 14. Буква Цифра над буквою Коефіцієнт 1s2 2s2 2р6 буква ― вказує на форму орбіталі цифра над
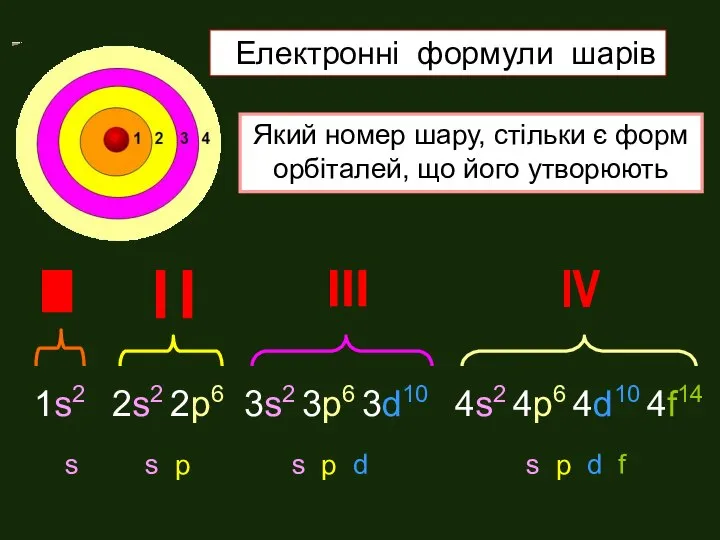
- 15. 1s2 2s2 2р6 3s2 3р6 3d10 4s2 4р6 4d10 4f14 Який номер шару, стільки є форм
- 16. Правила заповнення електронами енергетичних рівнів і підрівнів 1). Спочатку електронами заповнюється перший енергетичний рівень, потім другий,
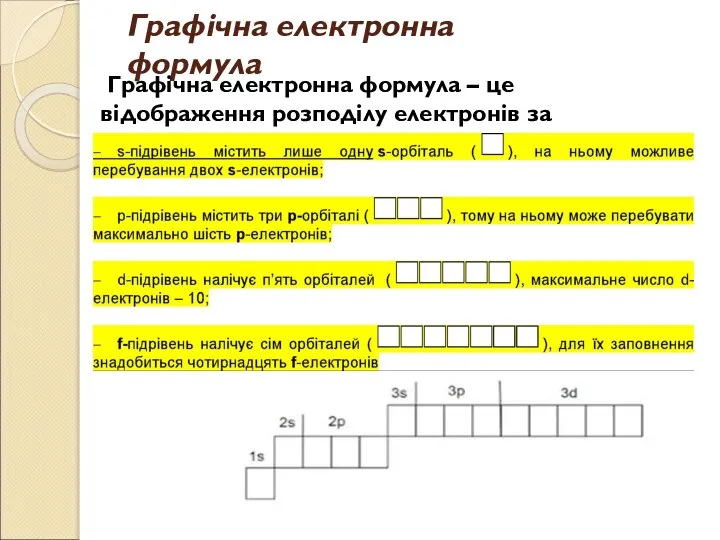
- 17. Графічна електронна формула Графічна електронна формула – це відображення розподілу електронів за енергетичними комірками.
- 19. Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл.
- 22. Скачать презентацию







 Газ тәрізді өнімдер бромды сутек
Газ тәрізді өнімдер бромды сутек Предельные углеводороды (алканы)
Предельные углеводороды (алканы) Физические величины для подсчета числа частиц вещества
Физические величины для подсчета числа частиц вещества Сопротивление материалов коррозии
Сопротивление материалов коррозии Углеводороды. Урок-игра
Углеводороды. Урок-игра Dereglarea metabolismului
Dereglarea metabolismului Алканы
Алканы Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия
Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия Растворы. Определение
Растворы. Определение Химические реактивы
Химические реактивы Типы химической связи
Типы химической связи Различия в молекулярном строении газов, жидкостей и твердых тел
Различия в молекулярном строении газов, жидкостей и твердых тел Химические процессы на кухне (урок №7)
Химические процессы на кухне (урок №7) Металлическая и водородная и химическая связь
Металлическая и водородная и химическая связь 1.2. Измерения веществ
1.2. Измерения веществ Сероводород и сульфиды
Сероводород и сульфиды Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Конструирование макромолекул методом ATRP
Конструирование макромолекул методом ATRP Сода: мифы и реальность
Сода: мифы и реальность Электролитическая диссоциация
Электролитическая диссоциация Cиликат кальция
Cиликат кальция Научный эксперимент в химической технологии
Научный эксперимент в химической технологии Закон эквивалентов
Закон эквивалентов Презентация на тему Алюминий(Al)
Презентация на тему Алюминий(Al)  Ступенчатые процессы получения полимеров: полиприсоединение, поликонденсация
Ступенчатые процессы получения полимеров: полиприсоединение, поликонденсация Получение аминов
Получение аминов Химические свойства воды
Химические свойства воды Основания. Состав оснований
Основания. Состав оснований