Слайд 2Цель урока
Дать характеристику серы на атомарном, молекулярном и макроуровне

Слайд 3План урока
Сера в природе
Атомы серы
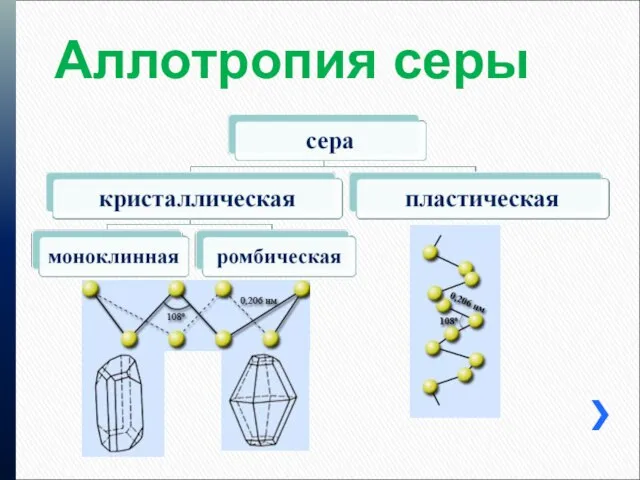
Аллотропия серы
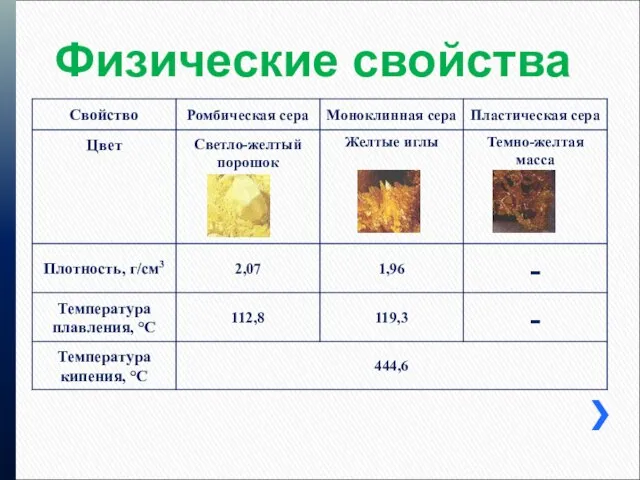
Физические свойства
Химические свойства
Применение серы
Биологическая роль серы

Слайд 4Исторические сведения
Сера известна с глубокой древности и упоминается Гомером в «Одиссее» как

лекарство от недугов.
В Древнем Египте серу использовали для приготовления красок, косметических средств.
В Древней Греции, сжигая серу, дезинфицировали помещение и вещи.
В Древнем Риме ее использовали для лечения кожных заболеваний.
В средние века сера была одним из «начал» у алхимиков, считалась необходимой составной частью «философского камня».
Слайд 5Этимология названия
В отличие от кислорода (от лат. Oxigenium – «рождающий кислоту»), селена

(от лат. Selene – Луна) и теллура (от лат. Tellus – Земля), происхождение названия «сера» неизвестно.
Слайд 6Сера в природе
Какие природные соединения, содержащие серу, вам известны?

Слайд 7Сера в природе
киноварь HgS
халькопирит CuFeS2
галенит PbS
пирит FeS2
самородная сера S
гипс СаSO4.2H2O

Слайд 8Работа в тетрадях
Состав атомов
Строение атомов
Свойства атомов
Возможные значения валентности и степени окисления
Для серы

укажите:
Слайд 11Работа в тетрадях
5. Физические свойства серы
Ф.С.:
Тв., желтая, хрупкая, Н,
Р в CS2,

не смачивается водой, плохо проводит тепло и ток
Слайд 12Химические свойства
Какими окислительно-восстановительными свойствами обладает сера?

Слайд 13Химические свойства
Сера – окислитель
Сера – восстановитель
При взаимодействии с какими веществами сера проявляет

окислительные, а с какими – восстановительные свойства?
Слайд 14Химические свойства
Сера – окислитель
Сера – восстановитель
Закончите уравнения реакций:
S + H2 =
S

+ Na =
S + Fe =
S + Hg =
S + O2 =
S + F2 =
Слайд 15Химические свойства
Сера – окислитель
Сера – восстановитель
Закончите уравнения реакций:
S + H2 =
S

+ Na =
S + Fe =
S + Hg =
S + O2 =
S + F2 =
H2S
SF6
SO2
Na2S
FeS
HgS
3
2
Слайд 16 Почему сера в соединениях с металлами проявляет степень окисления –2,
а в

соединениях с кислородом и галогенами +4 и +6?
Слайд 17Химические свойства
Составьте уравнение реакции взаимодействия серы с бертолетовой солью, зная, что в

результате ее образуется хлорид калия и сернистый газ.
Рассмотрите эту реакцию как окислительно-восстановительную
Слайд 18Применение серы
Производство серной кислоты
Получение резины
Получение гидросульфата кальция (для производства бумаги)
Производство пороха, пиротехники
Получение

«сусального золота» – SnS2
В медицине для лечения кожных заболеваний
В сельском хозяйстве для борьбы с вредителями
Слайд 19Биологическая роль серы
Сера участвует в ОВР в организмах растений и животных
Сера входит

в состав белков и аминокислот
Особенно много серы в волосах, шерсти, рогах, копытах
Соединения серы обнаружены в хрящах, костях, в желчи
Слайд 20Домашнее задание
Учебник: §21, упр. 1, 4, 5


















 9-8 кислоты в свете ТЭД (1)
9-8 кислоты в свете ТЭД (1) Производство серной кислоты
Производство серной кислоты Карбоциклические соединения. Циклоалканы
Карбоциклические соединения. Циклоалканы Свойства углеводородов
Свойства углеводородов КАРБОНОВЫЕ КИСЛОТЫ Органическая химия 11 класс
КАРБОНОВЫЕ КИСЛОТЫ Органическая химия 11 класс Неметаллы. 8 класс
Неметаллы. 8 класс Презентация на тему Стронций
Презентация на тему Стронций  Углеродистые конструкционные стали
Углеродистые конструкционные стали Презентация на тему Дисахариды
Презентация на тему Дисахариды  Лекция 3
Лекция 3 Коррозия металлов
Коррозия металлов Температурная зависимость времени спин-решеточной релаксации протонов в H2La2Ti3O10
Температурная зависимость времени спин-решеточной релаксации протонов в H2La2Ti3O10 Метаболизм липидов
Метаболизм липидов Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат
Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат Презентация на тему Растворение. Растворы (8 класс)
Презентация на тему Растворение. Растворы (8 класс)  Получение дисперсных систем. Метод конденсации. Метод диспергирования. Эффект Ребиндера. Лекция 11
Получение дисперсных систем. Метод конденсации. Метод диспергирования. Эффект Ребиндера. Лекция 11 Металлы II А подгруппы
Металлы II А подгруппы Аминокислоты. Классификация, номенклатура
Аминокислоты. Классификация, номенклатура Физические и химические явления
Физические и химические явления Химия и нанотехнологии
Химия и нанотехнологии Метаболизм азота
Метаболизм азота Стероиды. Дицетин-холестерин-ацилтрансферазная реакция
Стероиды. Дицетин-холестерин-ацилтрансферазная реакция Электронное строение
Электронное строение Химический состав молока
Химический состав молока Теория химического строения органических веществ А.М. Бутлерова
Теория химического строения органических веществ А.М. Бутлерова Предельные углеводороды. Алканы (1)
Предельные углеводороды. Алканы (1) Презентация на тему Предельные одноатомные спирты
Презентация на тему Предельные одноатомные спирты  Химические реакции. Вещество
Химические реакции. Вещество