Содержание
- 2. 1.Познакомиться с видами химической связи и типами кристаллической решетки веществ. 2.Нучится давать характеристику химической связи 3.Закрепить
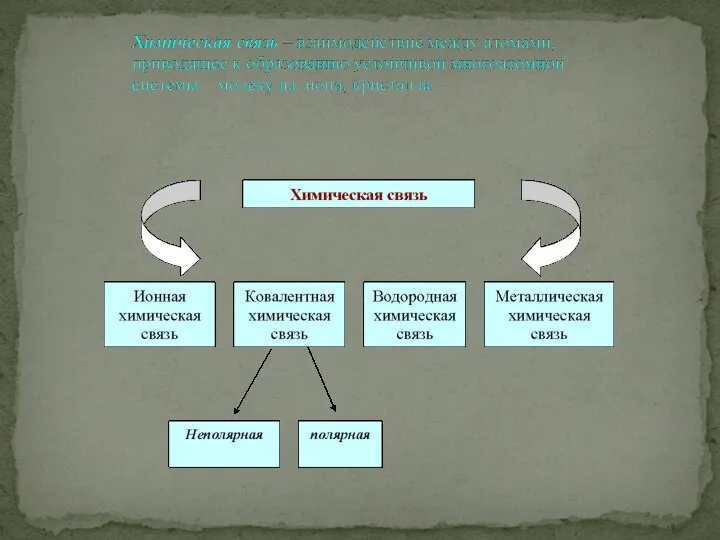
- 3. ХИМИЧЕСКАЯ СВЯЗЬ - сила, связывающая атомы в молекулы или другие частицы между собой.
- 4. ХИМИЧЕСКАЯ СВЯЗЬ - - совокупность электростатических сил притяжения, связывающих атомы друг с другом.
- 6. 1. Ионная связь -связь, образующаяся между ионами противоположного знака в результате электростатического притяжения.
- 7. Возникает между ионами, имеющими большую разность электроотрицательности (более 2); Образуется между ионами металлов и неметаллов; Ионная
- 8. Ионные соединения 1. соединения типичных металлов и неметаллов; 2. Соли кислородсодержащих кислот; 3. Щёлочи; 4.Соли аммония
- 9. Сульфат никеля Ионные соединения.
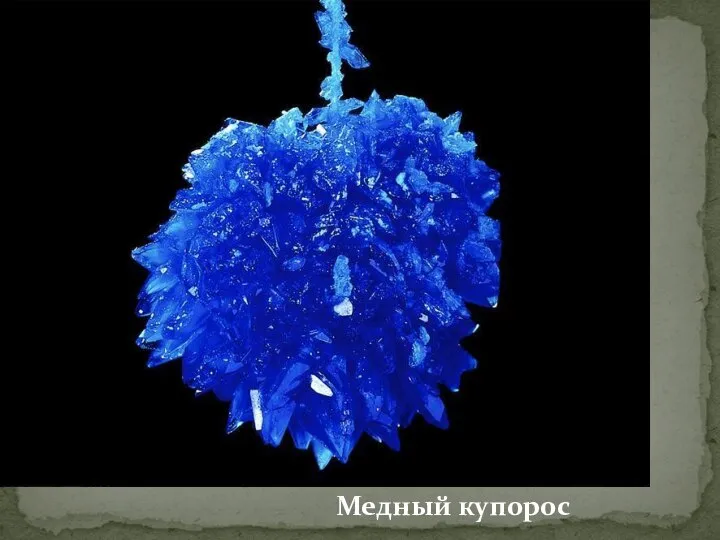
- 10. Медный купорос
- 11. Природный кристалл каменной соли
- 13. По обменному механизму: каждый атом предоставляет в общую электронную пару один неспаренный электрон: По донорно-акцепторному механизму:
- 14. Образуется между одинаковыми атомами (О2,Н2 и т.д.) При обычных условиях они являются газами. Б.Ковалентно-полярная связь: Образуется
- 15. Механизм образования водородной связи близок к донорно-акцепторному ( R –Н δ+ …. Э δ- – R)
- 16. Агрегатное состояние-твердые вещества. Примеры-все металлы, кроме ртути. 4.Металлическая химическая связь- связь в металлах.
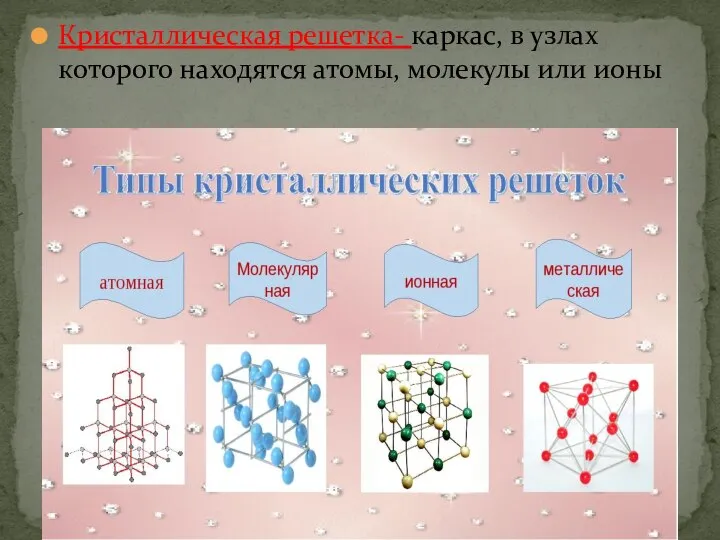
- 17. Кристаллическая решетка- каркас, в узлах которого находятся атомы, молекулы или ионы
- 18. Кристалл — это твердое вещество, в котором частицы расположены закономерно, образуя кристаллическую решетку.
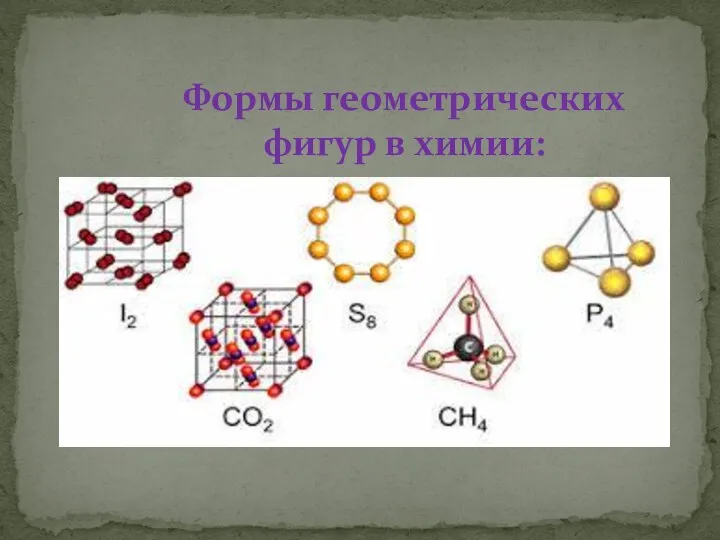
- 19. Формы геометрических фигур в химии:
- 20. А. Связь ионная Б. Физические свойства: тугоплавкие, нелетучие, твердые, растворимы, проводят электрический ток Примеры: соли, щелочи.
- 21. Свойства: 1.Высокая твердость, 2.Высокая температура плавления. 3.Связь прочная. Примеры: Алмаз, кремний, бор SiO2, Al2O3. 2.Атомная решетка:
- 22. Свойства: 1.Связь ковалентная. 2.Невысокая температура плавления. 3.Вещества в жидком состоянии, газообразном. 4.Связь непрочная. Примеры: неметаллы, вода,
- 23. Свойства: 1.Вещества твердые. 2.Пластичные. 3.Ковкие. Связь металлическая. Примеры: все металлы, кроме ртути. 4.Металлическая решетка- в узлах
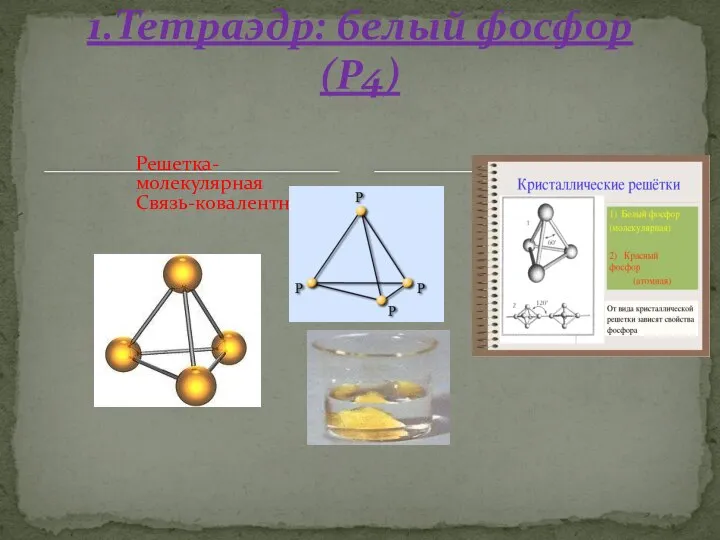
- 24. 1.Тетраэдр: белый фосфор (Р4) Решетка-молекулярная Связь-ковалентная.
- 25. 2.Куб: хлорид натрия(NaCl) Решетка-ионная химическая связь- ионная
- 26. 2.Куб: Пирит(FeS2) Медный купорос (CuSO₄) Решетка-ионная, химическая связь-ионная
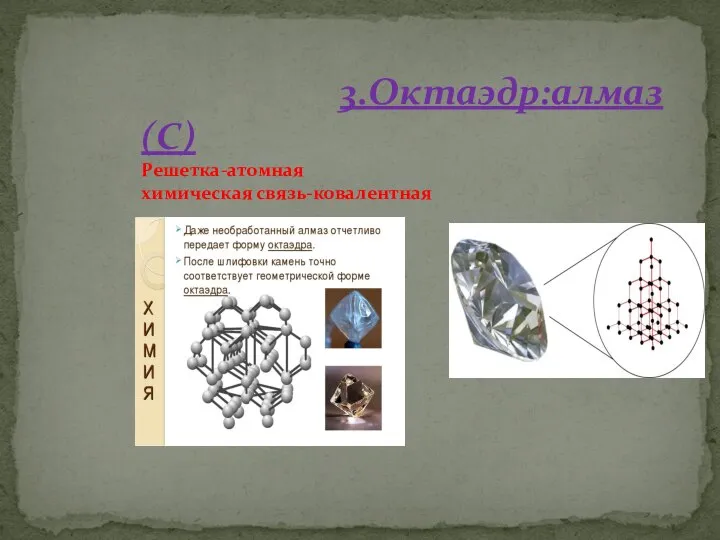
- 27. 3.Октаэдр:алмаз(С) Решетка-атомная химическая связь-ковалентная
- 28. 3.Октаэдр: кварц (SiO2) Решетка-атомная химическая связь-ковалентная
- 29. 4.Додекаэдр: рубин, гранат (Fe3Al2[SiO4]3) решетка-атомная химическая связь-ковалентная
- 30. 5.Икосаэдр: бор кристаллический (В). Решетка-атомная химическая связь-ковалентная
- 31. 1.Назовите тип химической связи в соляной кислоте. А.ковалентная б.ионная в.металлическая 2.Какая связь в поваренной соли? А.ковалентная
- 32. Определите, кристаллы каких веществ изображены на экране:
- 33. Домашнее задание в СДО: 1.Определить тип химической связи и вид кристаллической решетки: 1.Золото. 2.Вода. 3.Хлор. 4.Соляная
- 34. Рефлексия:
- 36. Скачать презентацию





















![4.Додекаэдр: рубин, гранат (Fe3Al2[SiO4]3) решетка-атомная химическая связь-ковалентная](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1041188/slide-28.jpg)





 Кислоты, их состав и название
Кислоты, их состав и название Эквивалент. Закон эквивалентов
Эквивалент. Закон эквивалентов Презентация на тему Химия в криминалистике
Презентация на тему Химия в криминалистике  Понятие биотехнологии
Понятие биотехнологии Взаимодействие элементов-неметаллов между собой. 8 класс
Взаимодействие элементов-неметаллов между собой. 8 класс Презентация на тему Карбонаты
Презентация на тему Карбонаты  Активность каталазы
Активность каталазы Презентация на тему Роль йода в организме
Презентация на тему Роль йода в организме  Классификация неорганических соединений и реакций
Классификация неорганических соединений и реакций Химические реакторы. (Лекция 2)
Химические реакторы. (Лекция 2) Лаборатория мечты
Лаборатория мечты Альдегиды, строение и свойства
Альдегиды, строение и свойства Присоединение аммиака и аминов
Присоединение аммиака и аминов Характеристика щелочных металлов (9 класс)
Характеристика щелочных металлов (9 класс) Опыт тепло и холод. Поглощение тепла и кристаллическая ёлочка
Опыт тепло и холод. Поглощение тепла и кристаллическая ёлочка Ķīmiskais līdzsvars un faktori, kas to ietekmē
Ķīmiskais līdzsvars un faktori, kas to ietekmē Ацетиленовые углеводороды (алкины). Лекция №7
Ацетиленовые углеводороды (алкины). Лекция №7 Презентация на тему "Азотная кислота"
Презентация на тему "Азотная кислота" Основные типы химических реакций
Основные типы химических реакций Кислородсодержащие органические вещества. Тест
Кислородсодержащие органические вещества. Тест Стекло
Стекло Кальций
Кальций Исследование свойств модельной смеси сополимера Акритана-С с ЛД-70
Исследование свойств модельной смеси сополимера Акритана-С с ЛД-70 Уретановый каучук
Уретановый каучук Диеновые углеводороды
Диеновые углеводороды Электронное и пространственное строение молекулы метана Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ол
Электронное и пространственное строение молекулы метана Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ол Молибден. Получение молибдена
Молибден. Получение молибдена Презентация на тему Соединения химических элементов
Презентация на тему Соединения химических элементов