Содержание
- 2. Металлы Сu, Au, Ag не взаимодействуют с водой даже при нагревании. Металлы обладают электропроводностью и теплопроводностью.
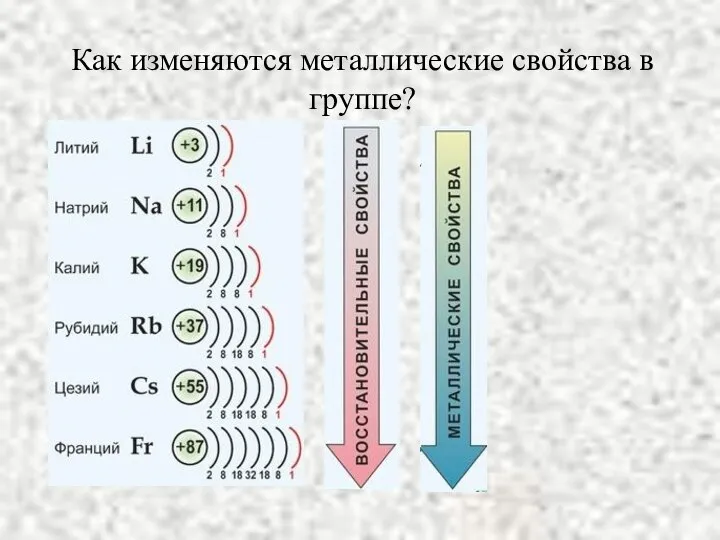
- 3. Как изменяются металлические свойства в группе?
- 4. Радиусы атомов элементов 1А группы
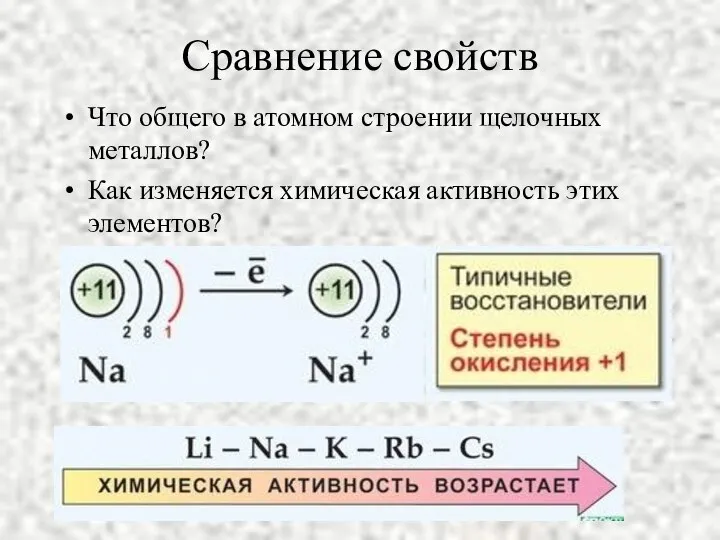
- 5. Сравнение свойств Что общего в атомном строении щелочных металлов? Как изменяется химическая активность этих элементов?
- 6. ИСТОРИЯ ОТКРЫТИЯ Натрий и калий – 1807г. Английский химик и физик Г.Дэви получил их в виде
- 7. Происхождение названий Li (1817) лат. " литос" - камень Na (1807) араб. "натрум" - сода К
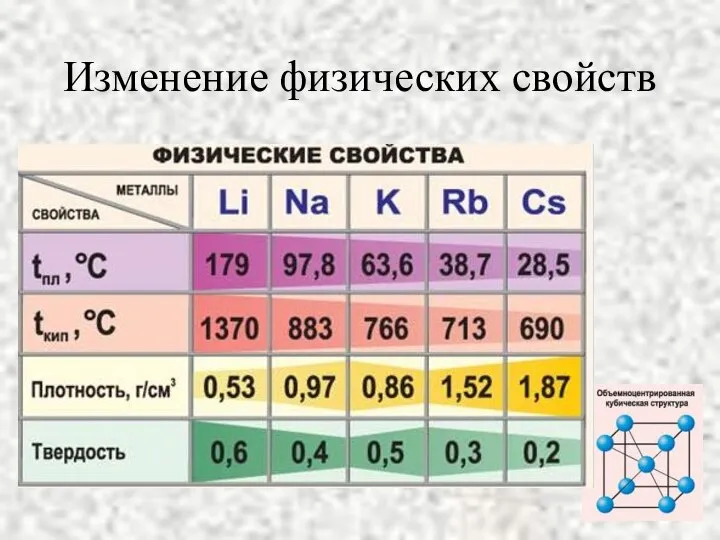
- 8. Изменение физических свойств
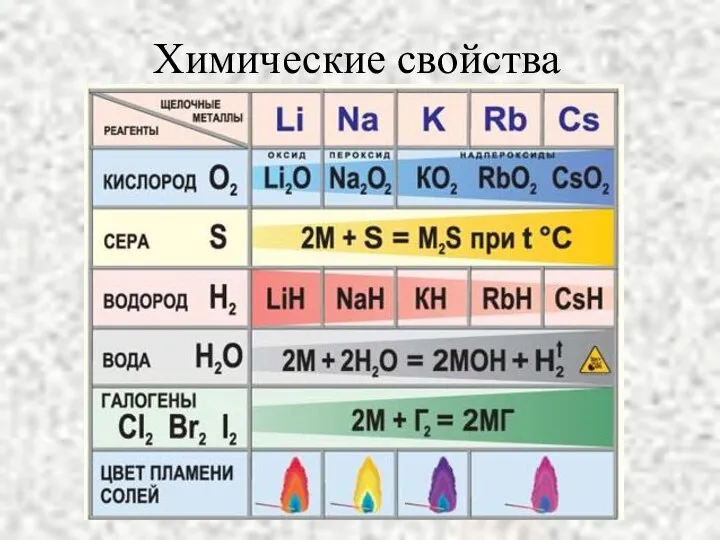
- 9. Химические свойства
- 10. Оксид лития Оксид натрия Оксиды щелочных металлов Составьте общую формулу оксидов.
- 11. KOH – гидроксид калия NaOH – гидроксид натрия LiOH – гидроксид лития Гидроксиды щелочных металлов Какова
- 12. Нахождение в природе Встречаются ли щелочные металлы в природе в свободном состоянии?
- 14. Немного истории Древнегреческий поэт Гомер, назвал поваренную соль «божественной». В те далекие времена она ценилась выше
- 15. Поваренная соль и география Поваренная соль известна человеку с незапамятных времен, и название ее сходно во
- 16. Поваренная соль в организме человека Соль – обязательная составная часть организма человека. Соль поддерживает нормальную деятельность
- 17. Применение поваренной соли Производство химических веществ --- соляной кислоты --- гидроксида натрия --- хлора --- соды
- 18. Сколько нужно времени для того, чтобы съесть пуд соли? Есть поговорка: «Чтобы хорошо узнать человека, надо
- 19. Карбонат калия - поташ Калийная селитра соли щелочных металлов
- 21. Скачать презентацию














 Углерод
Углерод Галогениды, нитраты и сульфаты лантаноидов
Галогениды, нитраты и сульфаты лантаноидов Степени окисления и формулы веществ
Степени окисления и формулы веществ Композитные материалы
Композитные материалы Электролитическая диссоциация
Электролитическая диссоциация Проверочный тест. Номенклатура алканов
Проверочный тест. Номенклатура алканов Вероятность протекания химических реакций
Вероятность протекания химических реакций 42. Ионные уравнения
42. Ионные уравнения Электролитическая диссоциация
Электролитическая диссоциация Защитить кабель. Задача 9
Защитить кабель. Задача 9 Многоатомные спирты
Многоатомные спирты Физико-химические методы анализа. Лекция 4
Физико-химические методы анализа. Лекция 4 Вычисление массовой доли элемента в молекуле
Вычисление массовой доли элемента в молекуле Комплексные соединения
Комплексные соединения Карбоновые кислоты
Карбоновые кислоты Основные понятия химии
Основные понятия химии Стекло. Определение стекла
Стекло. Определение стекла Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева
Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева Производные салициловой, пара-аминобензойной кислот, применяемые в медицине
Производные салициловой, пара-аминобензойной кислот, применяемые в медицине Химия углеводов
Химия углеводов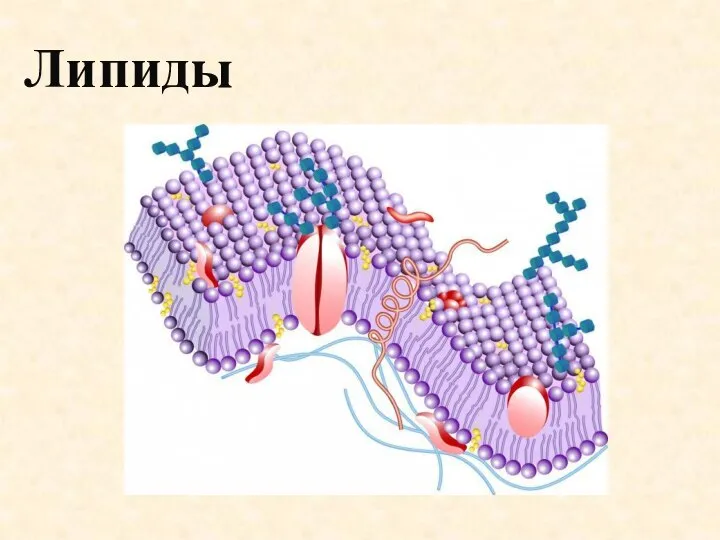 Липиды. Источники
Липиды. Источники Основные формулы МКТ
Основные формулы МКТ Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов Генетичні зв’язки між неорганічними речовинами
Генетичні зв’язки між неорганічними речовинами Генетическая связь неорганических соединений
Генетическая связь неорганических соединений Воздух
Воздух Toshkent davlat texnika instituti
Toshkent davlat texnika instituti 9_OSNOVY_KOLANALIZA
9_OSNOVY_KOLANALIZA