Содержание
- 2. Lielākā daļa no visām reakcijām ir apgriezeniskas. Tas nozīmē, ka no reakcijas produktiem var veidoties izejvielas.
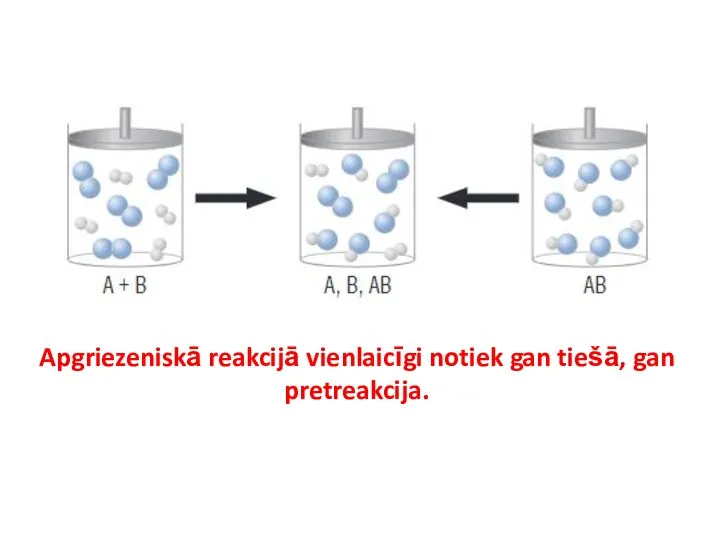
- 3. Apgriezeniskā reakcijā vienlaicīgi notiek gan tiešā, gan pretreakcija.
- 4. Tajos gadījumos, kad tiešā un apgriezeniskā reakcijas noris ar vienādu ātrumu, iestājas ķīmiskais līdzsvars. Līdzsvara stāvoklī
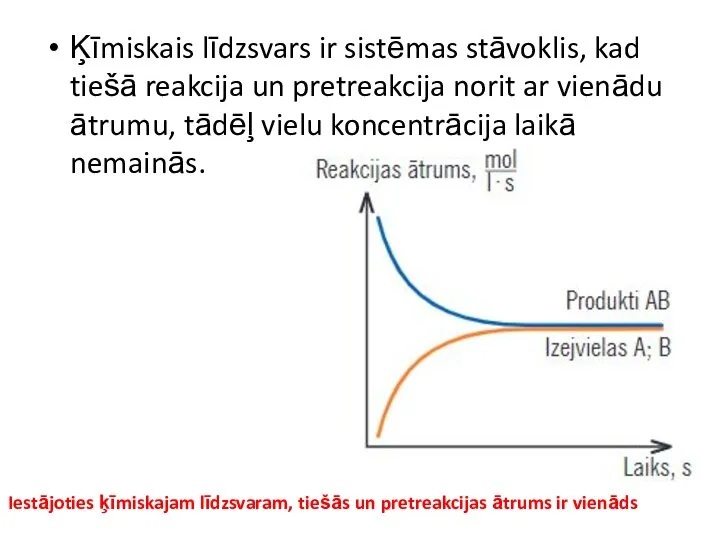
- 5. Ķīmiskais līdzsvars ir sistēmas stāvoklis, kad tiešā reakcija un pretreakcija norit ar vienādu ātrumu, tādēļ vielu
- 6. Piemērs:
- 7. No praktiskā viedokļa ir ļoti būtiski zināt gan katras reaģējošās vielas koncentrāciju līdzsvara stāvoklī, gan arī
- 8. Piemēram: Ķīmisko vielu ražošanā ir izdevīgi izmantot tādas reakcijas, kurās līdzsvara stāvoklī reakciju produktu koncentrācija ir
- 9. Tā kā līdzsvara stāvoklī abu reakciju ātrumi ir vienādi vt= vp, tad varam rakstīt: vt –
- 10. Ķīmiskā līdzsvara konstante ir atkarīga no reaģējošo vielu dabas un temperatūras, bet nav atkarīga no vielu
- 12. Ja sistēmā līdzsvara stāvoklī nemainīgā temperatūrā maina kādas vielas (izejvielas vai produkta) koncentrāciju, mainās arī pārējo
- 13. Līdzsvara konstantei ir liela praktiska nozīme.Pēc tās skaitliskās vērtības var spriest par reakcijas norisi. Ja līdzsvara
- 14. Ja līdzsvara konstante Klīdzsvara Tas nozīmē, ka līdzsvars tiek vērsts pretreakcijas virzienā.
- 15. Nemainoties ārējiem apstākļiem, ķīmiskais līdzsvars var pastāvēt neierobežoti ilgi. Tiešās reakcijas ātrums vtun pretreakcijas ātrums vpir
- 16. Reaģējošo vielu maisījums cenšas sasniegt jaunu līdzsvara stāvokli vt= vp, kurā ir citas vielu līdzsvara koncentrācijas,
- 17. Ārējo apstākļu (koncentrācijas, spiediena, temperatūras) maiņa līdzsvarā esošā sistēmā no divām pretējām reakcijām palielina tās reakcijas
- 18. Ja līdzsvarā esošu vielu maisījuma temperatūra un spiediens nemainās, tad līdzsvaru var ietekmēt, pievadot vai aizvadot
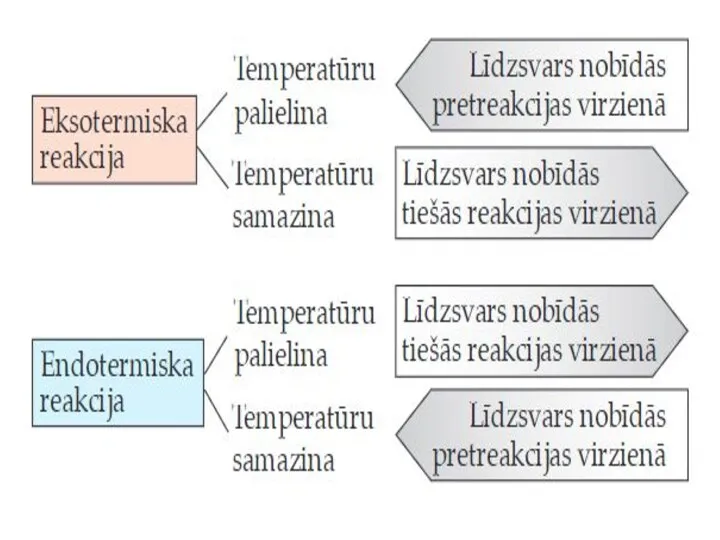
- 19. Paaugstinot temperatūru, ķīmiskais līdzsvars pārvietojas endotermiskās reakcijas virzienā. Temperatūru pazeminot, ķīmiskais līdzsvars pārvietojas eksotermiskās reakcijas virzienā.
- 22. Скачать презентацию
















 Проект синтеза бензина для промышленных целей отделения Д-3 цеха Д 2-6-3-5-12
Проект синтеза бензина для промышленных целей отделения Д-3 цеха Д 2-6-3-5-12 Степени окисления химических элементов в соединениях
Степени окисления химических элементов в соединениях Алкены. Непредельные углеводороды
Алкены. Непредельные углеводороды Строение , свойства и биологическая роль гликолипидов. Тема 14
Строение , свойства и биологическая роль гликолипидов. Тема 14 Алканы. Физические свойствава алканов
Алканы. Физические свойствава алканов Химия как наука. Краткая история развития химии. Значение химии
Химия как наука. Краткая история развития химии. Значение химии Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость
Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость Полимеры и пластмассы
Полимеры и пластмассы Блок колонн на установке замедленного коксования производительностью 730000 тонн/год гудрона (поз.к-1, кх-1)
Блок колонн на установке замедленного коксования производительностью 730000 тонн/год гудрона (поз.к-1, кх-1) Ионная связь
Ионная связь Метаболизм липидов
Метаболизм липидов Адамсит. Дигидрофенарсазинхлорид HN(C6H4)2AsCl
Адамсит. Дигидрофенарсазинхлорид HN(C6H4)2AsCl Задача 11 Ртутное сердце Команда: Мастера Беспорядка
Задача 11 Ртутное сердце Команда: Мастера Беспорядка Окислительно=восстановительное титрование
Окислительно=восстановительное титрование Альдегиды. Строение молекул
Альдегиды. Строение молекул Алгебраический метод решения задач В-9 – элемент решения задач С4
Алгебраический метод решения задач В-9 – элемент решения задач С4 Расчет равновесного состояния системы натрий-кислород-водород, для энергетических ядерных реакторов
Расчет равновесного состояния системы натрий-кислород-водород, для энергетических ядерных реакторов Презентация на тему Хлор
Презентация на тему Хлор  Классификация коррозионных процессов металлов
Классификация коррозионных процессов металлов Классификация и номенклатура ОС
Классификация и номенклатура ОС Путешествие в мир кислот
Путешествие в мир кислот Строение и химические свойства галогенов
Строение и химические свойства галогенов Знакомый и незнакомый углерод (9 класс)
Знакомый и незнакомый углерод (9 класс) Термореактивные пластмассы (реактопласты)
Термореактивные пластмассы (реактопласты) Реакции разложения
Реакции разложения Определение степеней окисления и расстановка коэффициентов в ОВР
Определение степеней окисления и расстановка коэффициентов в ОВР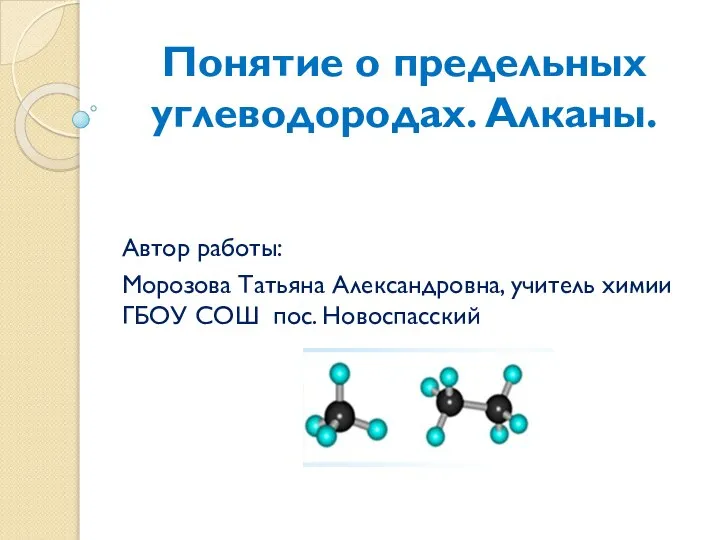 Понятие о предельных углеводородах. Алканы
Понятие о предельных углеводородах. Алканы