Содержание
- 2. Ацетилен (CnH2n-2) 3 2 Объем производства – 5 млн. т в год! Ацетилен (tкип=−84°C), впервые был
- 3. Номенклатура 3 3 По номенклатуре IUPAC названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан»
- 4. Изомерия 3 3 Изомерия алкинов связана с положением тройной связи: И с изомерией углеродного скелета:
- 5. Промышленные способы получения алкинов 3 4 1. Неполное окисление предельных углеводородов: 2. Окислительный пиролиз (электрокрекинг): 3.
- 6. Лабораторные способы получения алкинов 3 5 1. Дегидрогалогенирование: 3 5
- 7. Лабораторные способы получения алкинов 3 5 2. Дегалогенирование тетрагалогеналканов: 3. Через металлоорганические соединения (алкилирование ацетиленидов): 4.
- 8. Физические свойства алкинов 3 5 Закономерности в изменении температур плавления и кипения в ряду ацетиленовых углеводородов
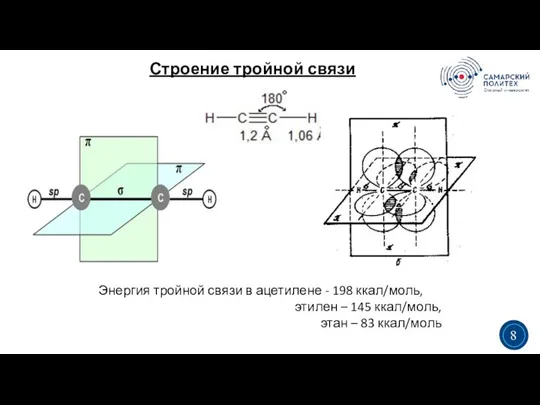
- 9. Строение тройной связи 3 5 Энергия тройной связи в ацетилене - 198 ккал/моль, этилен – 145
- 10. Строение тройной связи 3 5 3 13 Две гибридизированные sp-орбитали (по одной от каждого атома углерода)
- 11. Химические свойства алкинов 3 5 ≡C-H связь в ацетилене сильно поляризована из-за большего ee s-характера при
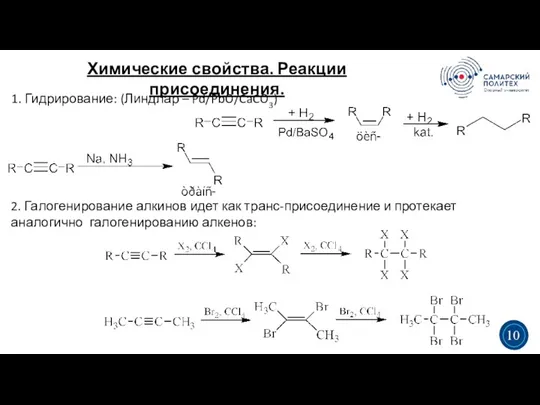
- 12. Химические свойства. Реакции присоединения. 3 5 1. Гидрирование: (Линдлар – Pd/PbO/CaCO3) 3 10 2. Галогенирование алкинов
- 13. Химические свойства. Реакции присоединения. 3 5 3. Гидрогалогенирование. Реакция идёт по правилу Марковникова (AdE): 3 11
- 14. Химические свойства. Реакции присоединения. 3 5 4. Гидратация. В присутствии солей ртути алкины присоединяют воду с
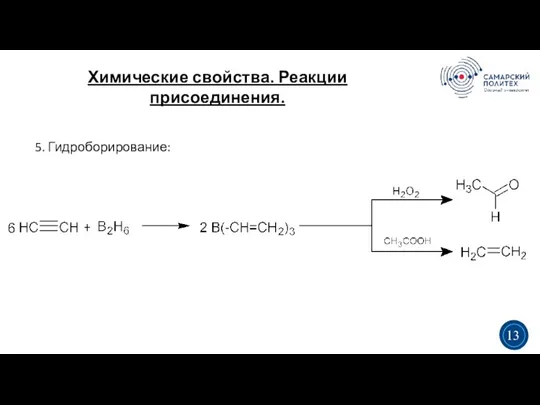
- 15. Химические свойства. Реакции присоединения. 3 5 5. Гидроборирование: 3 13
- 16. Химические свойства. Реакции присоединения. 3 5 3 14 6. Реакции винилирования: Механизм:
- 17. Химические свойства. Реакции присоединения. 3 5 3 26 7. Уксусная кислота взаимодействует с ацетиленом по следующей
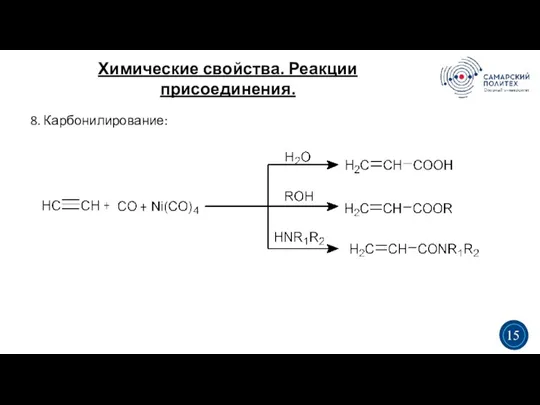
- 18. Химические свойства. Реакции присоединения. 3 5 3 15 8. Карбонилирование:
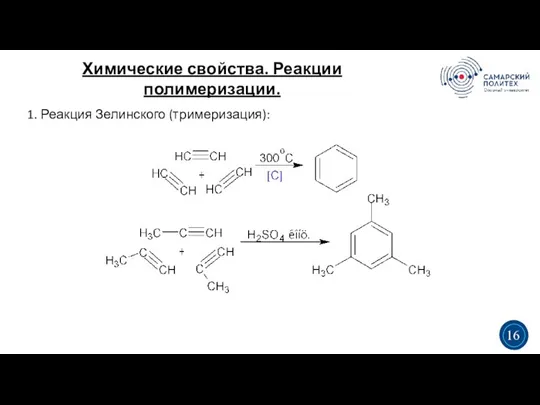
- 19. Химические свойства. Реакции полимеризации. 3 5 3 16 1. Реакция Зелинского (тримеризация):
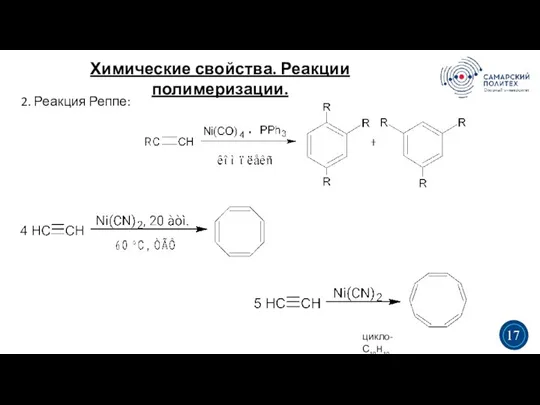
- 20. Химические свойства. Реакции полимеризации. 3 5 3 17 2. Реакция Реппе: цикло-С10H10
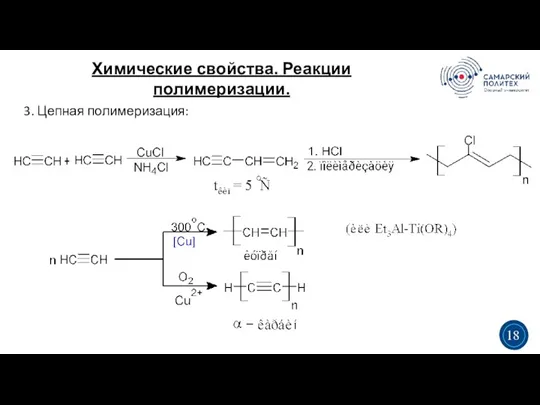
- 21. Химические свойства. Реакции полимеризации. 3 5 3 18 3. Цепная полимеризация:
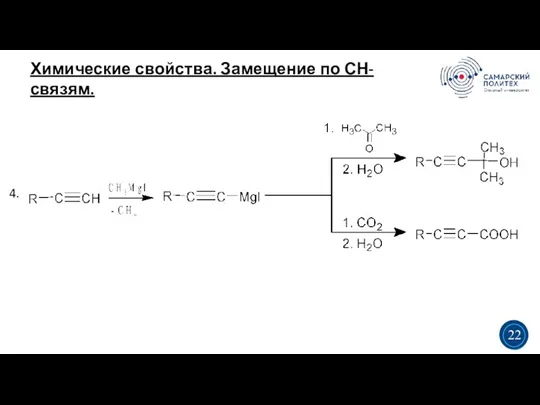
- 22. Химические свойства. Замещение по СН-связям. 5 19 1. 2. 3 3 20
- 23. Химические свойства. Замещение по СН-связям. 5 19 3. 3 3 21 В реакции с [Cu(NH3)2]OH образуется
- 24. Химические свойства. Замещение по СН-связям. 5 19 4. 3 3 22
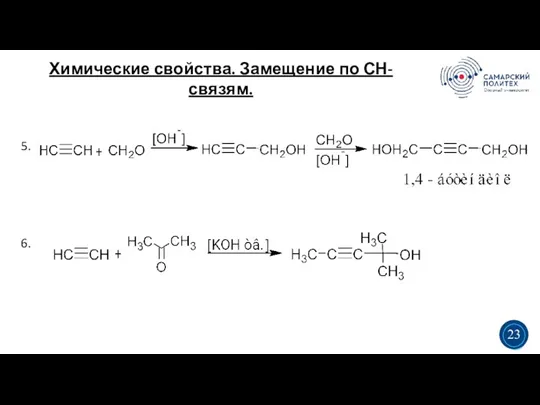
- 25. Химические свойства. Замещение по СН-связям. 5 19 5. 6. 3 3 23
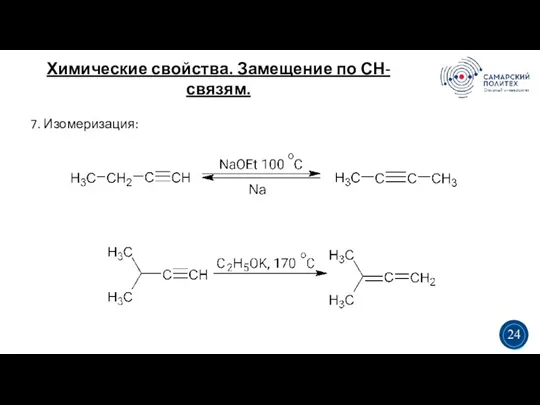
- 26. Химические свойства. Замещение по СН-связям. 5 19 7. Изомеризация: 3 3 24
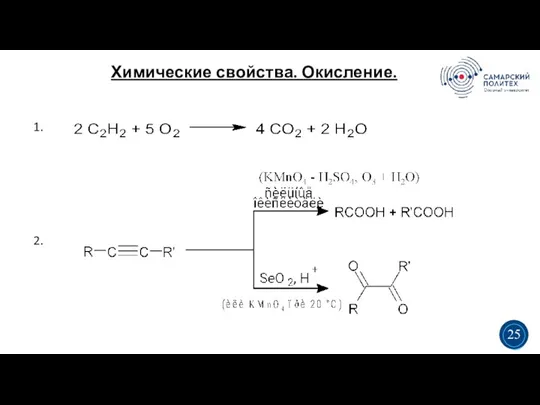
- 27. Химические свойства. Окисление. 5 19 1. 2. 3 3 25
- 29. Скачать презентацию















 Презентация на тему Законы газового состояния вещества
Презентация на тему Законы газового состояния вещества  Топология кристаллических структур. Топологические типы. Программы и базы данных для анализа топологии. Лекция 9
Топология кристаллических структур. Топологические типы. Программы и базы данных для анализа топологии. Лекция 9 Композиційні матеріали на основі функціоналізованих олігодієнів, вінілових мономерів і наповнювачів різної природи
Композиційні матеріали на основі функціоналізованих олігодієнів, вінілових мономерів і наповнювачів різної природи Полімер поліетилен
Полімер поліетилен Основания
Основания Реакции по направлению процесса
Реакции по направлению процесса Углеводороды. Характеристика
Углеводороды. Характеристика Общая характеристика элементов VII группы главной подгруппы. Хлор
Общая характеристика элементов VII группы главной подгруппы. Хлор Соли в свете теории электролитической диссоциации (ТЭД)
Соли в свете теории электролитической диссоциации (ТЭД) Температурная зависимость скорости химической реакции
Температурная зависимость скорости химической реакции Номенклатура и изомерия аренов
Номенклатура и изомерия аренов Степень окисления
Степень окисления Пропиновые кислоты
Пропиновые кислоты Метаболизм триацилглицеринов
Метаболизм триацилглицеринов Электролитическая диссоциация
Электролитическая диссоциация Углеводы
Углеводы Неорганические окислители и восстановители
Неорганические окислители и восстановители Изучение фотокатализа в химии
Изучение фотокатализа в химии Соединения железа
Соединения железа Аминокилоты. Получение и применение
Аминокилоты. Получение и применение Нефть и газ
Нефть и газ Ovr-1
Ovr-1 Рідкі кристали та їх властивості
Рідкі кристали та їх властивості Сероводород и сульфиды
Сероводород и сульфиды Примеры реакций в жизни и в быту
Примеры реакций в жизни и в быту Mechanika płynów
Mechanika płynów Лекция 4 Строение атома
Лекция 4 Строение атома кристал. решетки
кристал. решетки