Содержание
- 2. Цель урока: сформировать представления о валентности как свойстве атомов одного элемента присоединять, или замещать определённое число
- 3. Сравните качественный и количественный состав в молекулах: HCl, H2O, NH3, CH4. – Что общего в составе
- 4. Валентность - свойство атомов одного элемента присоединять к себе определенное число атомов другого элемента
- 5. – В начале XIX века Дж. Дальтоном был сформулирован закон кратных отношений, из которого следовало, что
- 6. Валентность обозначается римскими цифрами. I I I II III I IV I НCl H2O NH3 CH4
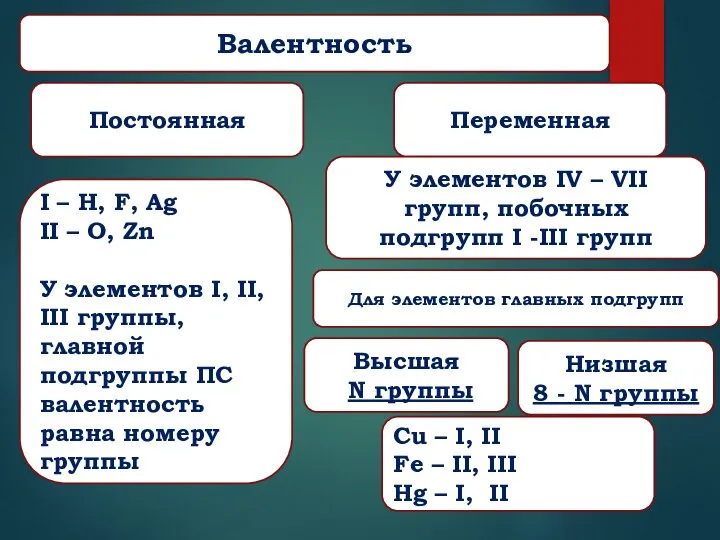
- 7. Переменная и постоянная валентность Есть элементы, которые имеют постоянную валентность: H, Li, Na, К, Rb, Cs,
- 8. Элементы с переменной валентностью Cu, Hg I,II Fe, Co, Ni II, III Sn, Pb, C II,
- 9. Валентность Постоянная Переменная I – H, F, Ag II – O, Zn У элементов I, II,
- 10. Алгоритм определения валентности элемента по формуле вещества: 1. над символами химических элементов с постоянной валентностью надписать
- 11. Определите валентность элементов в веществах SiH4, CrO3, H2S, CO2, CO, SO3, SO2, Fe2O3, FeO, HCl, HBr,
- 12. «Крестики-нолики» Выигрышный путь: одновалентные металлы. Выигрышный путь: трёхвалентные металлы.
- 13. Составление химических формул по валентности
- 14. 1 1. Запиши рядом знаки химических элементов, которые входят в состав вещества. Пример: Составить химическую формулу
- 15. 2. Над знаками химических элементов поставь их валентность. Пример: Составить химическую формулу оксида бора. B O
- 16. 3 3. Определи Н.О.К. чисел выражающих валентность этих элементов. Запиши Н.О.К. в квадратике над формулой. Пример:
- 17. 4 4. Раздели Н.О.К. на валентность каждого элемента. Запиши полученный индекс. Пример: Составить химическую формулу оксида
- 18. Выполнить одно из трёх заданий по выбору. Выбирайте только то задание, с которым вы справитесь. Репродуктивный
- 19. Классная работа: проработать презентацию, составить опорный конспект, выучить (слайд 7, 8, 9). Домашняя работа: выполнить письменное
- 21. Скачать презентацию

















 Карбонат калия K2CO3
Карбонат калия K2CO3 Вырсова И.Е.
Вырсова И.Е. Строение органических молекул. (Лекция 2)
Строение органических молекул. (Лекция 2) Язык естествознания. Химия
Язык естествознания. Химия صيغ المركبات وأسمائها
صيغ المركبات وأسمائها Предмет биоорганической химии. Лекция 1
Предмет биоорганической химии. Лекция 1 Химия в космосе Автор: Гриб Яна ученица 8а класса школа №484. Научный руководитель: Бирюкова Зоя Владимировна.
Химия в космосе Автор: Гриб Яна ученица 8а класса школа №484. Научный руководитель: Бирюкова Зоя Владимировна. Нафтены и арены
Нафтены и арены Алкилкарбон қышқылдарының тұздарын алу
Алкилкарбон қышқылдарының тұздарын алу Вода – уникальное вещество на планете Земля
Вода – уникальное вещество на планете Земля Интеллектуальная игра по химии, биологии, географии. Роль химических соединений. 10 класс
Интеллектуальная игра по химии, биологии, географии. Роль химических соединений. 10 класс Алкены. Непредельные углеводороды ряда этилена
Алкены. Непредельные углеводороды ряда этилена Щелочные металлы
Щелочные металлы Химия. Витамин В12
Химия. Витамин В12 Химия углеводов
Химия углеводов Электролитическая диссоциация
Электролитическая диссоциация Презентация по Химии "Соединения алюминия"
Презентация по Химии "Соединения алюминия"  Алканы. Химические свойства, получение и особенности
Алканы. Химические свойства, получение и особенности 10-2 основные положения теории Бутлерова
10-2 основные положения теории Бутлерова Классификация химических реакций. 11 класс
Классификация химических реакций. 11 класс Кислород как вещество
Кислород как вещество Кислоты основания и соли как электролиты
Кислоты основания и соли как электролиты Каучук. Строение и применение
Каучук. Строение и применение Неметаллы в ПСХЭ
Неметаллы в ПСХЭ Химическая связь. Строение вещества
Химическая связь. Строение вещества Реакция нейтрализации
Реакция нейтрализации Механизмы двухсубстатных реакций
Механизмы двухсубстатных реакций Disinfection without Chlorine and Chemistry
Disinfection without Chlorine and Chemistry