Содержание
- 2. Сванте-Август Аррениус Автор теории электролитической диссоциации. Лауреат Нобелевской премии Родился 19 февраля 1859 года в старинном
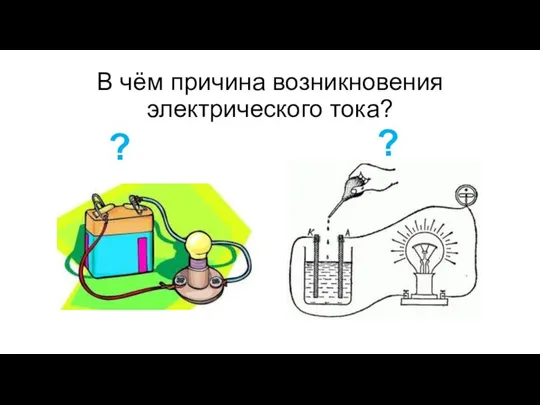
- 3. В чём причина возникновения электрического тока? ? ?
- 4. Причина возникновения электрического тока направленное движение электронов образование заряженных частиц в растворе или расплаве электролита
- 5. Все ли вещества проводят электрический ток? электролиты все растворимые соли щёлочи растворимые кислоты неэлектролиты нерастворимые соли,
- 6. Все ли вещества проводят электрический ток? электролиты NaCl (раствор) NaOH(раствор) Н2SO4 (раствор) СuSO4 (раствор) CH3COOH (раствор;
- 7. Какой вид химической связи у электролитов? ионная ковалентная полярная
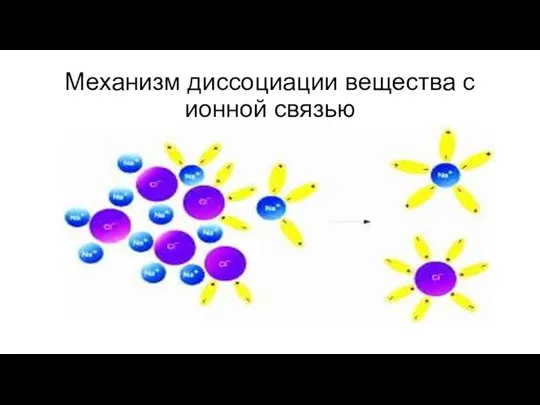
- 8. Механизм диссоциации вещества с ионной связью
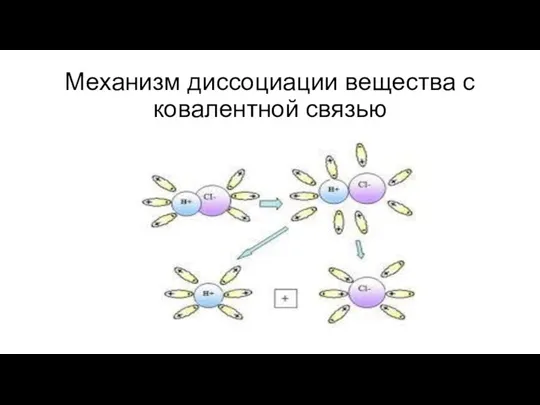
- 9. Механизм диссоциации вещества с ковалентной связью
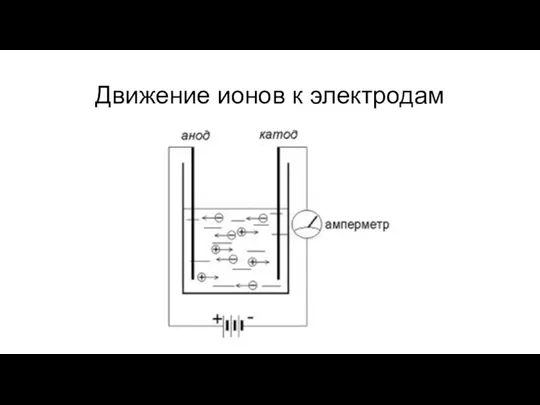
- 10. Движение ионов к электродам
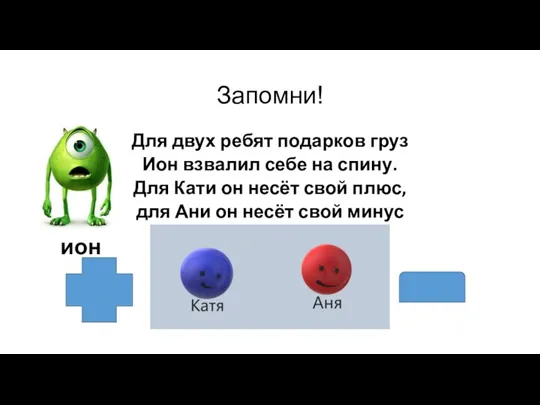
- 11. Запомни! Для двух ребят подарков груз Ион взвалил себе на спину. Для Кати он несёт свой
- 12. Электролитическая диссоциация - процесс распада электролита на ионы при растворении или расплавлении
- 13. Степень диссоциации -это отношение числа частиц, распавшихся на ионы (N д), к общему числу растворенных частиц
- 14. В зависимости от степени диссоциации электролиты делят на сильные электролиты 1.Практически все соли; 2.Сильные кислоты(HCl, HNO3,H2SO4и
- 15. Запишите уравнение диссоциации Допишите уравнения диссоциации NaCl = HCl= NaOH= CuSO4 = H2 SO4 = FeCl3
- 16. что мы сегодня узнали? 1. Какие вещества называются электролитами? Приведите примеры. 2. Почему эти вещества проводят
- 18. Скачать презентацию










 Капроновая (гексановая) кислота
Капроновая (гексановая) кислота Электролитическая диссоциация
Электролитическая диссоциация Обобщающий урок по теме: Изменения происходящие с веществами
Обобщающий урок по теме: Изменения происходящие с веществами Ковалентная полярная связь
Ковалентная полярная связь Влияние спиртов на организм человека
Влияние спиртов на организм человека Йод. Свойства
Йод. Свойства Аттестационная работа: Сравнение показателей качества меда разных производителей
Аттестационная работа: Сравнение показателей качества меда разных производителей Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Пластик: польза или вред
Пластик: польза или вред Вермикулитовый концентрат
Вермикулитовый концентрат Квест Секретная лаборатория. Первоначальные химические понятия. 8 класс
Квест Секретная лаборатория. Первоначальные химические понятия. 8 класс Презентация на тему Оксиды углерода
Презентация на тему Оксиды углерода  Когда образуется кислая соль?
Когда образуется кислая соль? Состояние электронов в атоме
Состояние электронов в атоме Сухой лёд
Сухой лёд Исследования в химической лаборатории УГПИ
Исследования в химической лаборатории УГПИ Презентация на тему Алкины. Ацетилен
Презентация на тему Алкины. Ацетилен  Презентация по Химии "Анилин"
Презентация по Химии "Анилин"  Водород. Вода
Водород. Вода Вещество. Свойства вещества. Урок №2
Вещество. Свойства вещества. Урок №2 Неидеальные растворы
Неидеальные растворы Гидролиз солей
Гидролиз солей Алканы
Алканы Планирование экспериментов предметной области кандидатской диссертации
Планирование экспериментов предметной области кандидатской диссертации Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Общие свойства растворов
Общие свойства растворов Минералы и горные породы
Минералы и горные породы Галоген тобы бар полимерлер
Галоген тобы бар полимерлер