Содержание
- 2. Тема: Гидролиз солей Цель: изучить сущность гидролиза солей в водных растворах. Задачи : сформулировать определение понятия
- 3. «ГИДРОЛИЗ» - от греческого «гидро» - вода «лизис» - разложение
- 4. ОКРАСКА ЛАКМУСА В РАЗЛИЧНЫХ СРЕДАХ
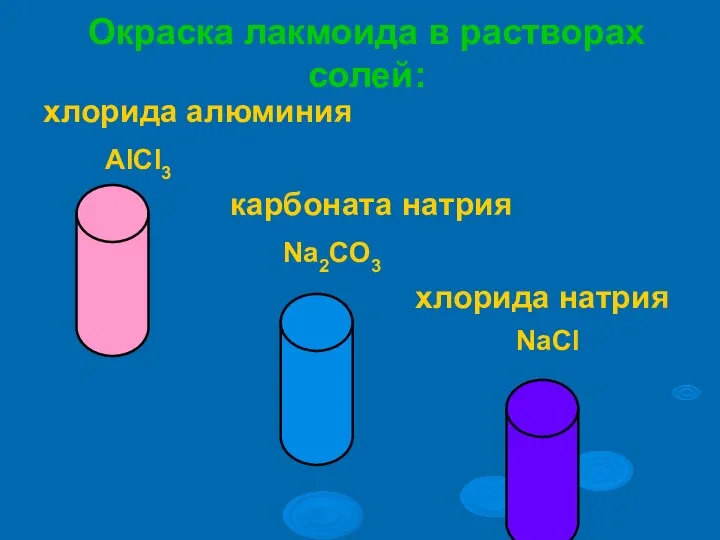
- 6. Окраска лакмоида в растворах солей: хлорида алюминия AlCl3 карбоната натрия Na2CO3 хлорида натрия NaCl
- 7. ОКРАСКА ЛАКМОИДА В РАСТВОРАХ СОЛЕЙ
- 8. Схема гидролиза хлорида алюминия AlCl3 Al(OH)3 HCl слабое основание сильная кислота [OH]- (что сильней того и
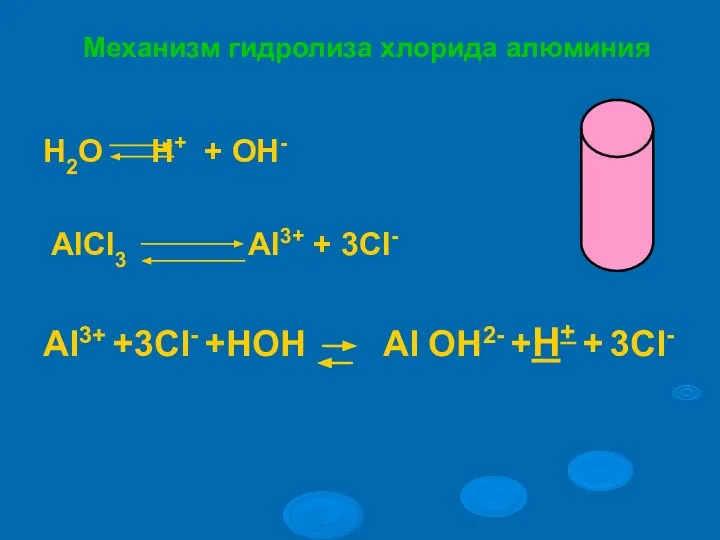
- 9. Механизм гидролиза хлорида алюминия H2O H+ + OH- AlCl3 Al3+ + 3Cl- Al3+ +3Cl- +HOH Al
- 10. АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ Определить состав соли, то есть указать, каким по силе основанием
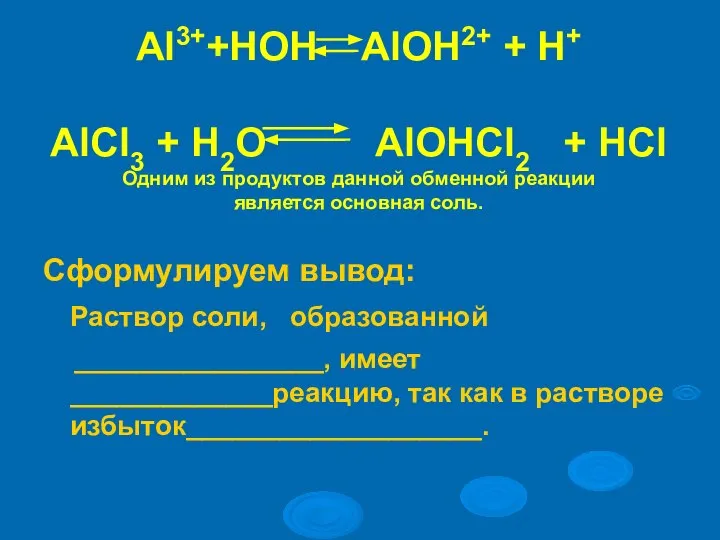
- 11. Al3++HOH AlOH2+ + H+ AlCl3 + H2O AlOHCl2 + HCl Одним из продуктов данной обменной реакции
- 12. Схема гидролиза карбоната натрия Na2CO3 NaOH H2CO3 сильное основание слабая кислота [OH]- > [H]+ (что сильней
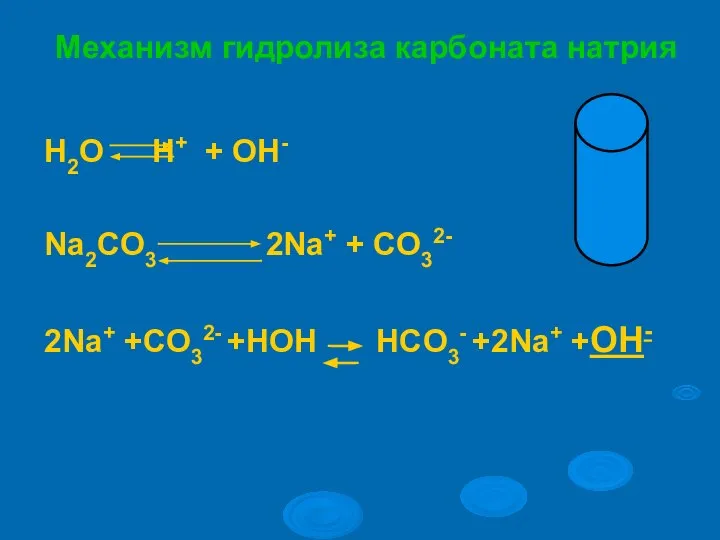
- 13. Механизм гидролиза карбоната натрия H2O H+ + OH- Na2CO3 2Na+ + CO32- 2Na+ +CO32- +HOH HCO3-
- 14. АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ Определить состав соли, то есть указать, каким по силе основанием
- 15. CO32- +HOH HCO3- +OH- Na2CO3 +H2O NaHCO3 +NaOH Одним из продуктов данной обменной реакции является кислая
- 16. Схема гидролиза карбоната натрия NaCl NaOH HCl сильное основание сильная кислота [OH]- = [H]+ Н е
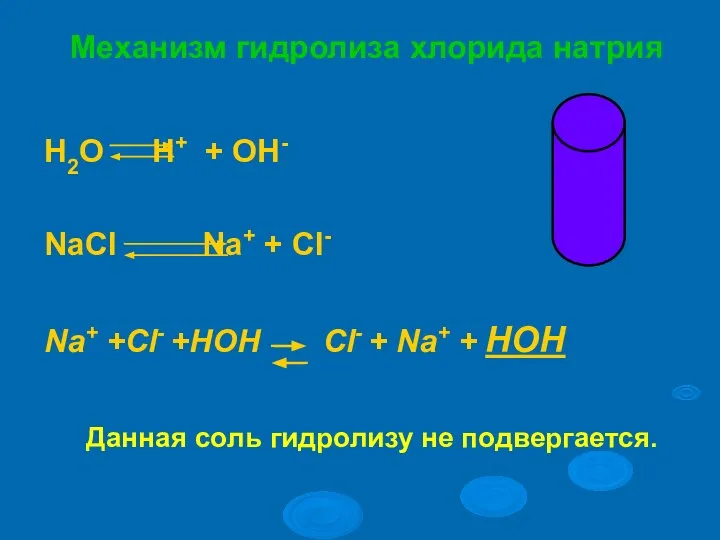
- 17. Механизм гидролиза хлорида натрия H2O H+ + OH- NaСl Na+ + Cl- Na+ +Cl- +HOH Cl-
- 18. NaCl + Н2О = Сформулируем вывод: Раствор соли, образованной__________________, имеет________________________реакцию, так как в растворе__________________________________.
- 19. Сформулируем определение понятия «гидролиз»: К какому типу мы отнесем данные реакции? Какие вещества в них участвуют?
- 20. ГИДРОЛИЗ – это реакция обмена между некоторыми солями и водой приводящая к образованию слабого электролита.
- 21. Самостоятельно заполните таблицу
- 22. Роль гидролиза в природе Преобразование земной коры Обеспечение слабощелочной среды морской воды
- 23. Роль гидролиза в народном хозяйстве Порча производственного оборудования Выработка из непищевого сырья ценных продуктов (бумага, мыло,
- 24. Роль гидролиза в повседневной жизни человека Стирка Мытье посуды Умывание с мылом Процессы пищеварения
- 26. Скачать презентацию





![Схема гидролиза хлорида алюминия AlCl3 Al(OH)3 HCl слабое основание сильная кислота [OH]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/960721/slide-7.jpg)

![Схема гидролиза карбоната натрия Na2CO3 NaOH H2CO3 сильное основание слабая кислота [OH]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/960721/slide-11.jpg)


![Схема гидролиза карбоната натрия NaCl NaOH HCl сильное основание сильная кислота [OH]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/960721/slide-15.jpg)







 Презентация на тему Серебро
Презентация на тему Серебро  Альдегиды и кетоны
Альдегиды и кетоны Металлы
Металлы Навчальний проект Дослідження зміни концентрації CO2 у класній кімнаті під час занять
Навчальний проект Дослідження зміни концентрації CO2 у класній кімнаті під час занять Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость
Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость Презентация на тему Щелочные и щелочноземельные металлы
Презентация на тему Щелочные и щелочноземельные металлы  Лайфхаки на кухне
Лайфхаки на кухне Ковалентная связь между одинаковыми атомами неметаллов
Ковалентная связь между одинаковыми атомами неметаллов Строение вещества
Строение вещества Презентация на тему Обобщение по типам химических реакций
Презентация на тему Обобщение по типам химических реакций  Материаловедение. Строение металлических материалов. Металлические сплавы
Материаловедение. Строение металлических материалов. Металлические сплавы Основы неорганической химии
Основы неорганической химии Альдегиды и кетоны
Альдегиды и кетоны Водород – топливо будущего
Водород – топливо будущего Ацетиленовые углеводороды (алкины). Лекция №7
Ацетиленовые углеводороды (алкины). Лекция №7 Разбор задач
Разбор задач Строение вещества. Химическая связь
Строение вещества. Химическая связь Внутренняя среда организма. Система крови. Физико-химические свойства крови
Внутренняя среда организма. Система крови. Физико-химические свойства крови Кислоты и соли
Кислоты и соли 9-14 Реакции в растворах электролитов
9-14 Реакции в растворах электролитов Получение метанола из синтез-газа
Получение метанола из синтез-газа Методы пробоотбора и пробоподготовки донных отложений, почв и грунтов
Методы пробоотбора и пробоподготовки донных отложений, почв и грунтов Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов История создания термометра: как придумали первый градусник?
История создания термометра: как придумали первый градусник? Презентация на тему Выдающиеся русские ученые химики
Презентация на тему Выдающиеся русские ученые химики  Кислотные оксиды
Кислотные оксиды Электроотрицательность (ЭО)
Электроотрицательность (ЭО) Физическая и коллоидная химия
Физическая и коллоидная химия