Содержание
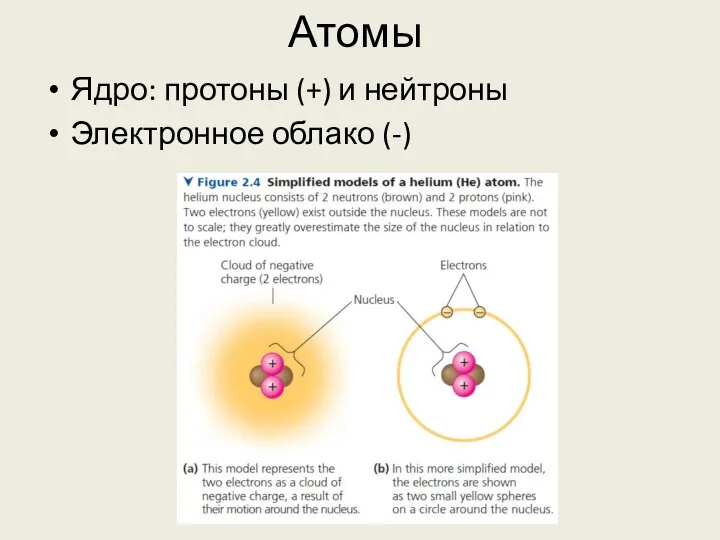
- 2. Атомы Ядро: протоны (+) и нейтроны Электронное облако (-)
- 3. Для измерения массы молекул используется дальтон (атомная единица массы) Нейтрон и протон почти одинаковы по массе
- 4. Найдите массовое и атомное число C, O, Ca
- 5. Изотопы Атомы с одинаковым число протонов, но разным числом нейтронов Радиоактивный изотоп – атом с нестабильным
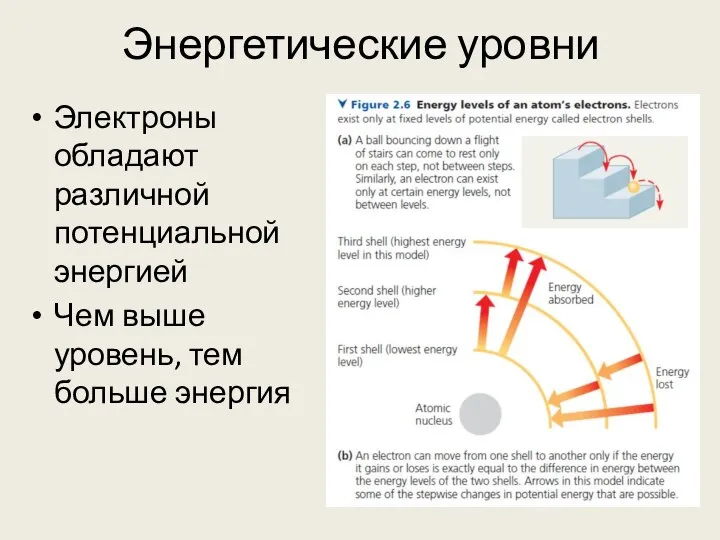
- 6. Энергетические уровни Электроны обладают различной потенциальной энергией Чем выше уровень, тем больше энергия
- 7. Период (строка в таблице) показывает число электронов на внешнем уровне Эти электроны называются валентными
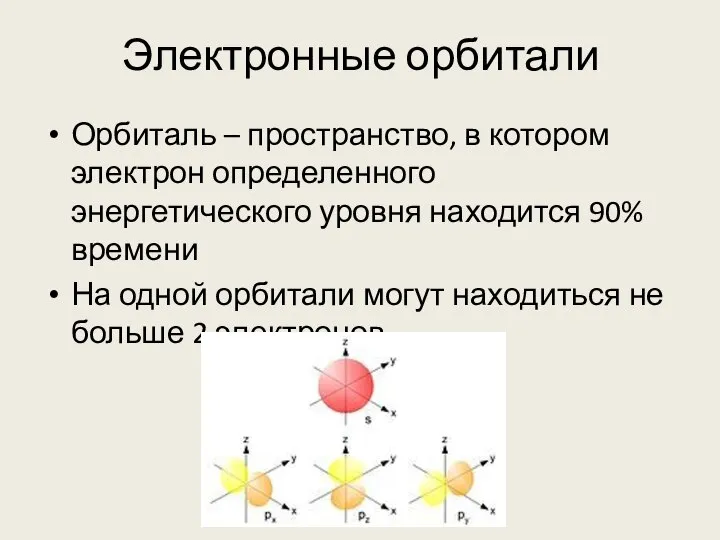
- 8. Электронные орбитали Орбиталь – пространство, в котором электрон определенного энергетического уровня находится 90% времени На одной
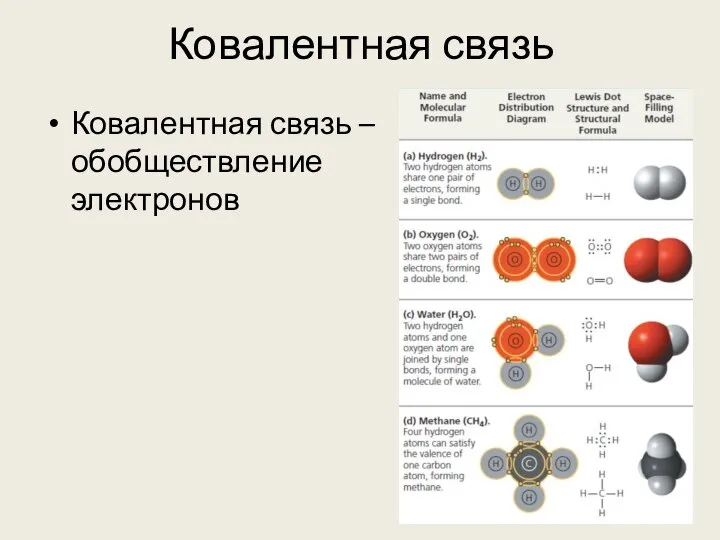
- 9. Ковалентная связь Ковалентная связь – обобществление электронов
- 10. Ковалентная связь Способность атома притягивать электроны – электроотрицательность Неполярная ковалентная связь – между атомами одного элемента
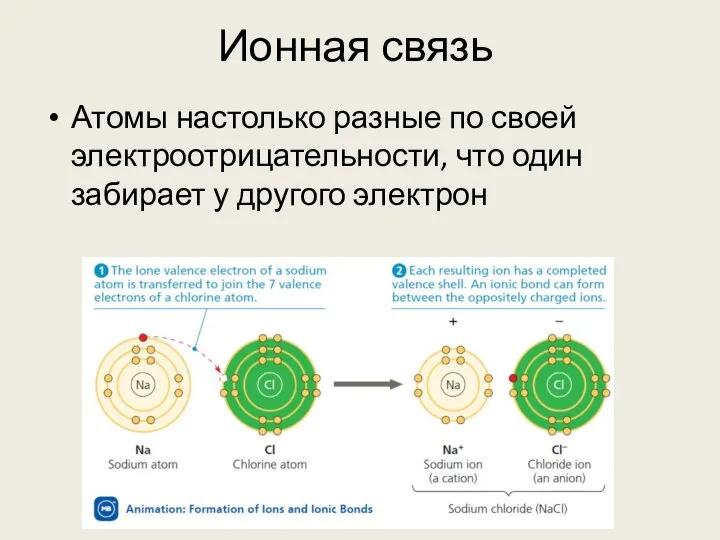
- 11. Ионная связь Атомы настолько разные по своей электроотрицательности, что один забирает у другого электрон
- 12. Ионная связь В результате возникают два иона: катион (положительно заряженный) и анион (отрицательно заряженный) Из-за разницы
- 13. Другие взаимодействия Водородная связь: притяжение частично положительно заряженного водорода к электроотрицательному атому
- 14. Другие взаимодействия Силы Ван-дер-Ваальса: электроны не всегда симметрично распределены по молекуле, они могут случайно скапливаться, из-за
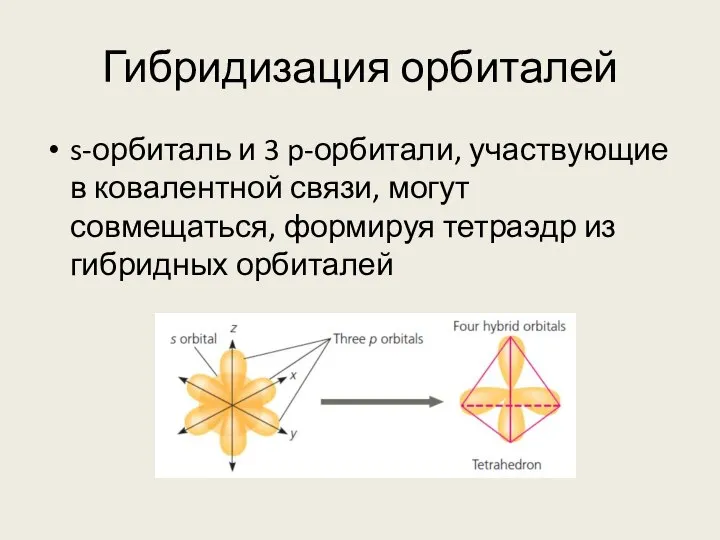
- 15. Гибридизация орбиталей s-орбиталь и 3 p-орбитали, участвующие в ковалентной связи, могут совмещаться, формируя тетраэдр из гибридных
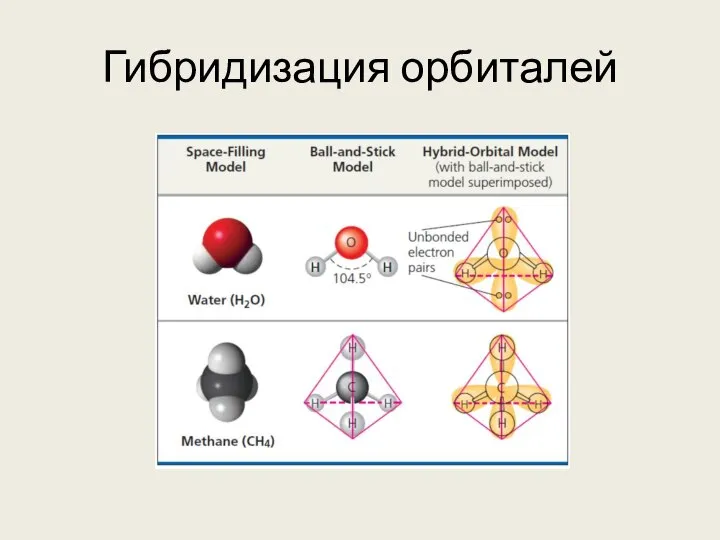
- 16. Гибридизация орбиталей
- 17. Форма молекулы очень важна Морфин может присоединяться к рецепторам натуральных эндорфинов
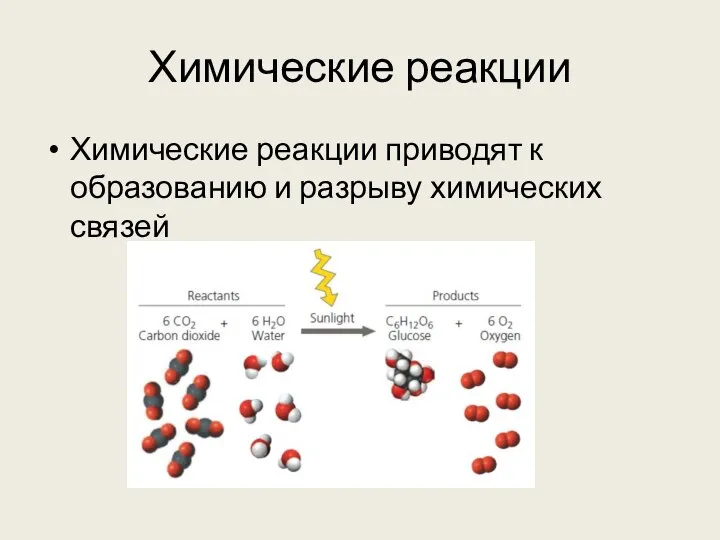
- 18. Химические реакции Химические реакции приводят к образованию и разрыву химических связей
- 19. Почему вода так необходима для жизни на Земле?
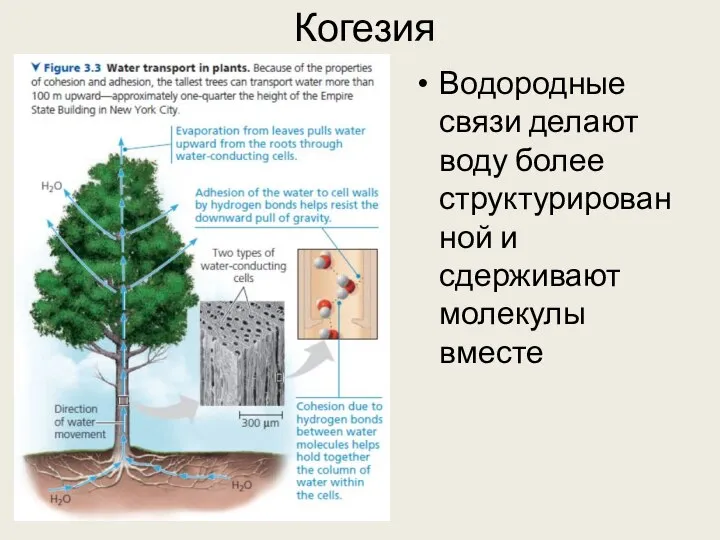
- 20. Водородные связи Свойства воды определяются во многом водородными связями
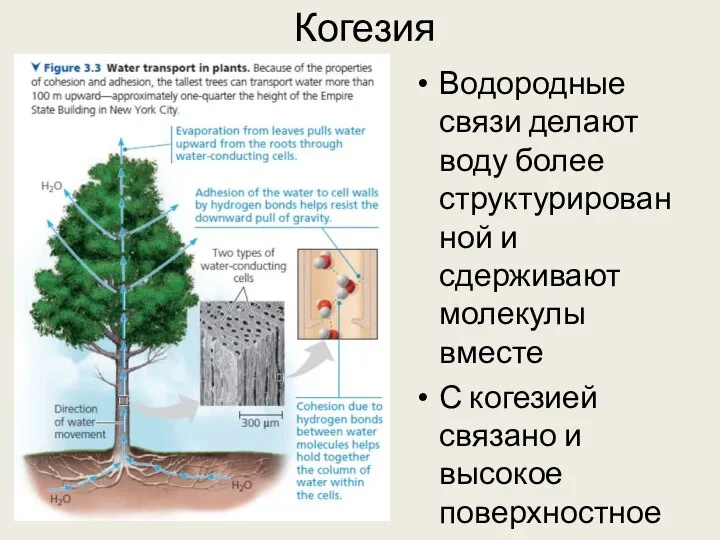
- 21. Когезия Водородные связи делают воду более структурированной и сдерживают молекулы вместе
- 22. Когезия Водородные связи делают воду более структурированной и сдерживают молекулы вместе С когезией связано и высокое
- 23. Большая теплоемкость Существенное увеличение тепловой энергии вызывает лишь сравнительно небольшое повышение температуры воды, так как значительная
- 24. Большая теплота испарения Количество тепловой энергии, необходимой для перехода воды в пар, очень высоко Энергия для
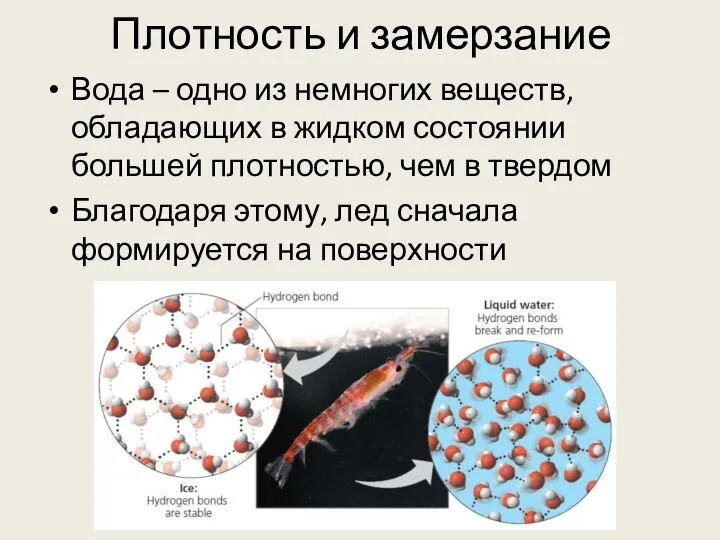
- 25. Плотность и замерзание Вода – одно из немногих веществ, обладающих в жидком состоянии большей плотностью, чем
- 26. Вода как растворитель Вода – превосходный растворитель для полярных (гидрофильных) веществ Молекулы воды окружают ионы, отделяя
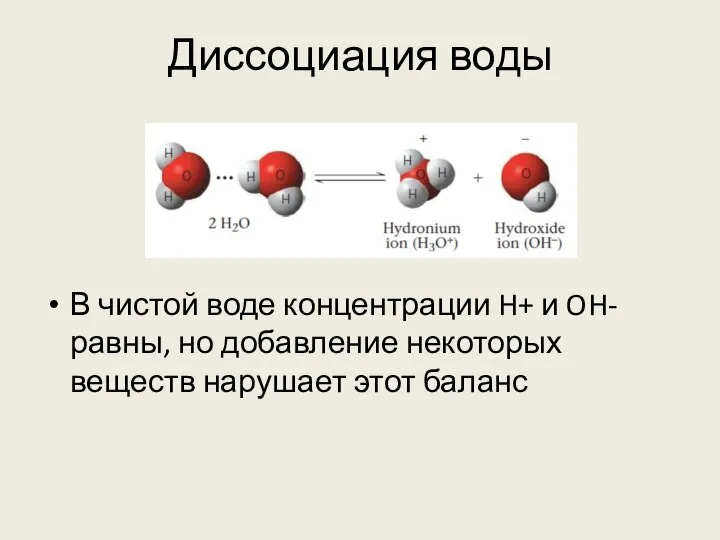
- 27. Диссоциация воды В чистой воде концентрации H+ и OH- равны, но добавление некоторых веществ нарушает этот
- 28. Водородный показатель Кислоты увеличивают концентрацию H+, основания – концентрацию OH- В любом водном растворе при 25°C
- 29. Чем меньше pH, тем больше кислотность раствора
- 30. Углерод Валентность – 4 Возможность образовывать огромное количество разных «скелетов»
- 31. Изомеры Вещества с одинаковой молекулярной формулой, но разной структурой Структурные, цис-транс изомеры и оптические изомеры (энантиомеры)
- 34. Скачать презентацию


















 Общие способы получения металлов
Общие способы получения металлов Concise asymmetric total synthesis of lycopodine
Concise asymmetric total synthesis of lycopodine Алкадиены. Строение. Гомологический ряд. Изомерия. Номенклатура
Алкадиены. Строение. Гомологический ряд. Изомерия. Номенклатура Минералы и горные породы
Минералы и горные породы Вещество. Кристаллические решетки
Вещество. Кристаллические решетки Стеариновая кислота
Стеариновая кислота Электроотрицательность (ЭО)
Электроотрицательность (ЭО) Химия неорганическая и органическая
Химия неорганическая и органическая Деформация аморфных и кристаллических полимеров
Деформация аморфных и кристаллических полимеров Кислород O2
Кислород O2 Строение и химический состав костей, рост костей
Строение и химический состав костей, рост костей Презентация на тему Строение атома и атомного ядра
Презентация на тему Строение атома и атомного ядра  Узагальнення знань з теми Вуглеводні
Узагальнення знань з теми Вуглеводні Химия крови. Диффузия, тургор, осмос в клетке
Химия крови. Диффузия, тургор, осмос в клетке Металлургия
Металлургия Турнир смекалистых. Все о кислотах
Турнир смекалистых. Все о кислотах Этиленгликоль
Этиленгликоль Презентация на тему Классификация химических реакций 11 класс
Презентация на тему Классификация химических реакций 11 класс  Получение антибиотиков
Получение антибиотиков ОВР. Метод электронного баланса
ОВР. Метод электронного баланса Молекулярно-кинетическая теория. Макро- и микропараметры
Молекулярно-кинетическая теория. Макро- и микропараметры Презентация на тему Сложные эфиры. Жиры
Презентация на тему Сложные эфиры. Жиры  Именем Менделеева Д.И названы
Именем Менделеева Д.И названы Исследовательский проект. Анализ состава соков разных производителей
Исследовательский проект. Анализ состава соков разных производителей Оксиды
Оксиды Кислород
Кислород Наркотики и прекурсоры
Наркотики и прекурсоры Презентация на тему Алканолы - Предельные одноатомные спирты
Презентация на тему Алканолы - Предельные одноатомные спирты