Содержание
- 2. Из истории открытия Строение атома Нахождение в природе Физические свойства Химические свойства Получение Оксид кальция Гидроксид
- 3. Из истории открытия 1808г англ. химик Хэмфри Дэви выделил металлический кальций электролитическим методом. Calcis – «известь»,
- 4. Строение атома Са +20 ) ) ) ) 2е 8е 8е 2е Степени окисления: 0, +2
- 5. Нахождение в природе 3,6% в земной коре CaCO3 - карбонат кальция( мел, мрамор, известняк) СаSO4● Н2О
- 6. Сталактиты Сталагмиты
- 7. Физические свойства Цвет : серебристо – белый Твёрдый Лёгкий (плотность 1,55 г / см3) Температура плавления
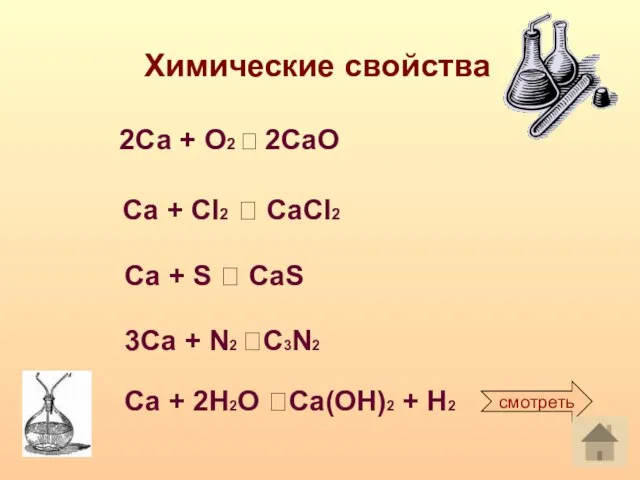
- 8. Химические свойства 2Са + О2 ? 2CаО Са + Сl2 ? CaCl2 Ca + S ?
- 9. Получение электролиз расплава СаСl2?Ca + Cl2 алюминотермия 3СаО + 2Аl ?3Ca + Al2O3
- 10. В промышленности кальций получают двумя способами: 1.Электролизом расплава CaCl2 и KCl с жидким медно-кальциевым катодом приготовляют
- 11. Биологическая роль
- 12. Оксид кальция СаО негашёная известь жжёная известь кипелка СаО + Н2О?Са(ОН)2 смотреть СаО + 2НСl ?CaCl2+H2O
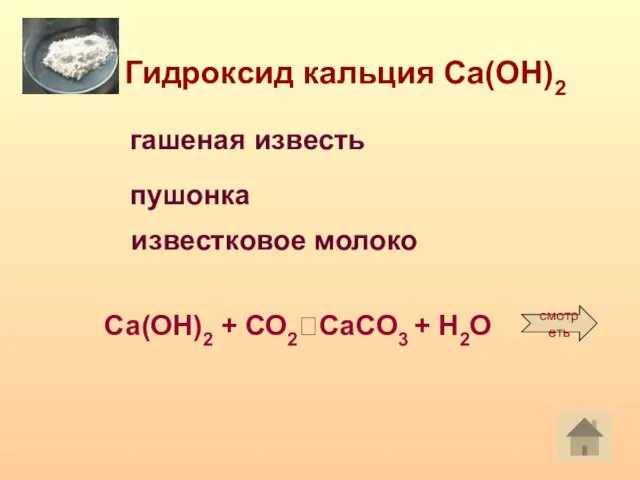
- 13. Гидроксид кальция Са(ОН)2 гашеная известь пушонка Са(ОН)2 + СО2?CaCO3 + H2O смотреть известковое молоко
- 14. Применение кальция и его соединений смотреть
- 15. Са-восстановитель U,Th,Cr,V,Zr,Cs,Rb и некоторых других металлов. Са-раскислитель сталей,бронз и других сплавов. Са используют для очистки аргона
- 16. Тест 1. Природное соединение кальция гипс отвечает формуле: а) CaCО3 б) CaSО4 в) Ca3(PО4)2 г) CaSО4
- 17. Домашнее задание § 41 упр. 1-7 Осуществить превращение Ca ? CaO? Ca(OH)2?CaCO3? Ca(HCO3)2
- 24. Скачать презентацию


















 Газообразные вещества и их применение
Газообразные вещества и их применение Порох. Сера, халькогены
Порох. Сера, халькогены Металлы. Строение, свойства, применение
Металлы. Строение, свойства, применение Атом. Ядро и электронная оболочка. Изотопы. Строение электронных оболочек атома. Понятие об орбиталях
Атом. Ядро и электронная оболочка. Изотопы. Строение электронных оболочек атома. Понятие об орбиталях ЕГЭ по химии: документы, регламентирующие структуру и содержание контрольных измерительных материалов
ЕГЭ по химии: документы, регламентирующие структуру и содержание контрольных измерительных материалов Неметаллы – химические элементы
Неметаллы – химические элементы Презентация на тему Этиловый спирт и его влияние на организм человека
Презентация на тему Этиловый спирт и его влияние на организм человека  Хроматография
Хроматография Химическое равновесие. Задачи
Химическое равновесие. Задачи Вода и её свойства
Вода и её свойства Неметаллы. Контрольная работа. 9 класс
Неметаллы. Контрольная работа. 9 класс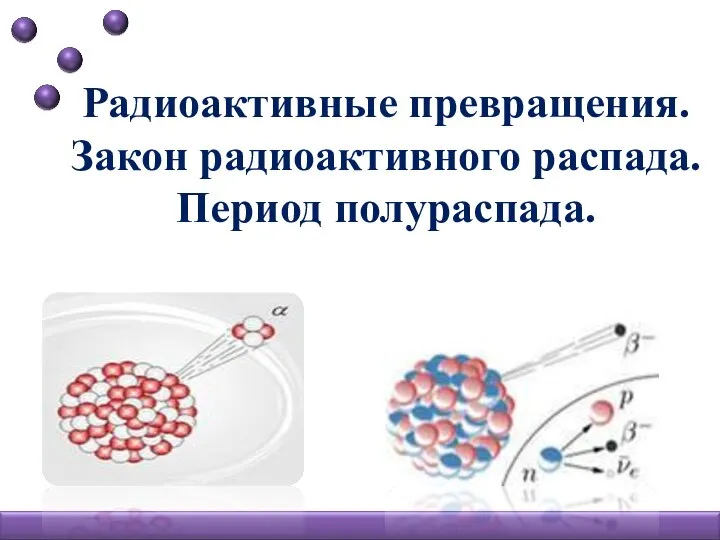 Радиоактивные превращения. Закон радиоактивного распада. Период полураспада
Радиоактивные превращения. Закон радиоактивного распада. Период полураспада Реакции обмена
Реакции обмена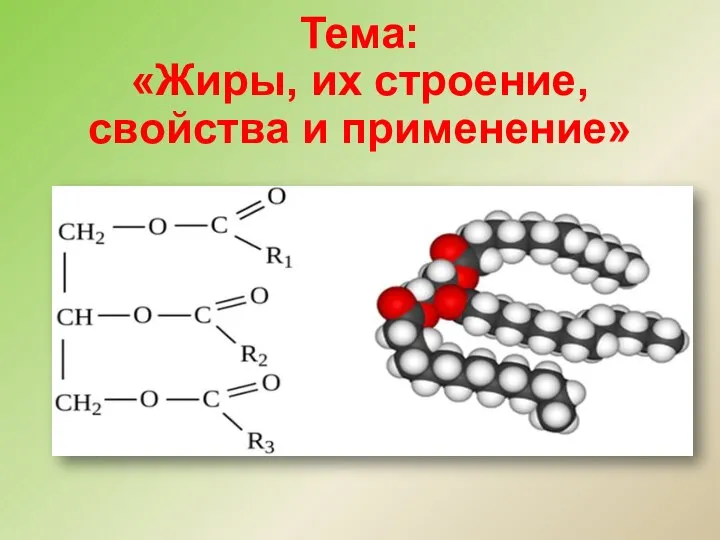 Жиры, их строение, свойства и применение
Жиры, их строение, свойства и применение Кислород
Кислород Хімічний експеримент
Хімічний експеримент Типичные реакции основных и кислотных оксидов
Типичные реакции основных и кислотных оксидов Физико-химические свойства нефтепродуктов
Физико-химические свойства нефтепродуктов Енергетика хімічних процесів
Енергетика хімічних процесів Использование элементов модульной технологии на уроках химии
Использование элементов модульной технологии на уроках химии Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства Буферные системы
Буферные системы Первое начало термодинамики (Закон сохранения и превращения энергии)
Первое начало термодинамики (Закон сохранения и превращения энергии) Метод валентных связей
Метод валентных связей Очистка поваренной соли
Очистка поваренной соли Амины. Номенклатура
Амины. Номенклатура Материаловедение. Технология конструкционных материалов. Диаграмма состояния Fe-Fe3C
Материаловедение. Технология конструкционных материалов. Диаграмма состояния Fe-Fe3C Лекция 6 Нарушения кислотнощелочного равновесия ацидозы, алкалозы
Лекция 6 Нарушения кислотнощелочного равновесия ацидозы, алкалозы