Содержание
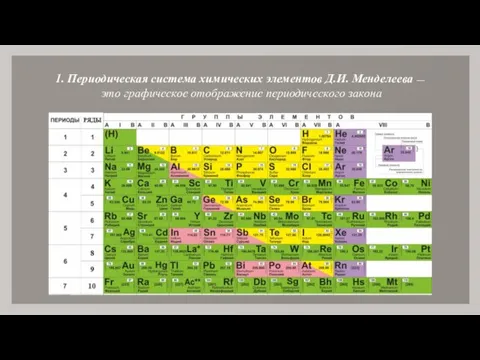
- 2. 1. Периодическая система химических элементов Д.И. Менделеева — это графическое отображение периодического закона
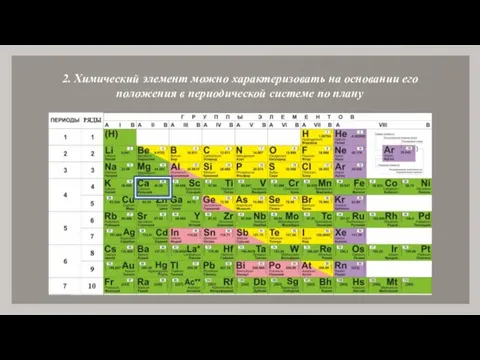
- 3. 2. Химический элемент можно характеризовать на основании его положения в периодической системе по плану
- 4. 3. Амфотерность — это свойство веществ проявлять кислотные или основные свойства в зависимости от природы реагента
- 5. Fe(OH)3 + HCl Fe(OH)3 + NaOH NaOH + H2SO4 NaOH + KOH Al(OH)3 + KOH
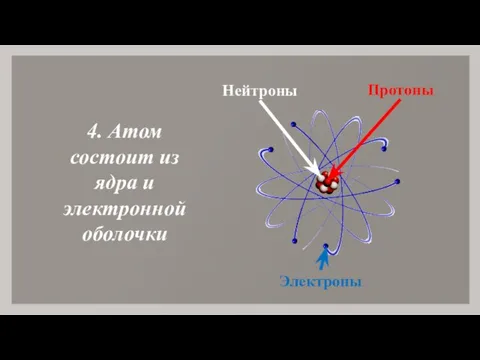
- 6. 4. Атом состоит из ядра и электронной оболочки Протоны Электроны Нейтроны
- 7. 5. Ядро состоит из протонов и нейтронов. Количество протонов соответствует порядковому номеру химического элемента. Масса атома
- 8. 6. Электроны располагаются вокруг ядра на электронной оболочке. Так как атом электронейтрален, количество электронов равно количеству
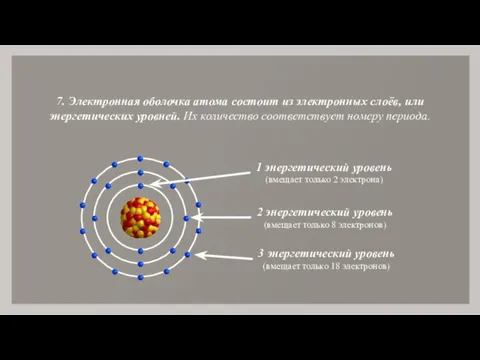
- 9. 7. Электронная оболочка атома состоит из электронных слоёв, или энергетических уровней. Их количество соответствует номеру периода.
- 10. 8. Различают завершённые (1-й уровень содержит два электрона, 2-й — восемь электронов, 3-й — восемнадцать) и
- 12. Скачать презентацию





 Кислоты
Кислоты Химия неметаллов: углерод, кремний
Химия неметаллов: углерод, кремний Альдегиды. Получение и применение. Общая формула альдегидов
Альдегиды. Получение и применение. Общая формула альдегидов Количество вещества
Количество вещества Строение и функции отдельных коферментов
Строение и функции отдельных коферментов Метод валентных связей
Метод валентных связей Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Технологии получения и преобразования текстильных материалов. Синтетические волокна (9 класс)
Технологии получения и преобразования текстильных материалов. Синтетические волокна (9 класс) Peek. Сферы применения
Peek. Сферы применения Химические равновесия в растворах. Константы равновесия при различном выборе стандартных состояний для участников реакции
Химические равновесия в растворах. Константы равновесия при различном выборе стандартных состояний для участников реакции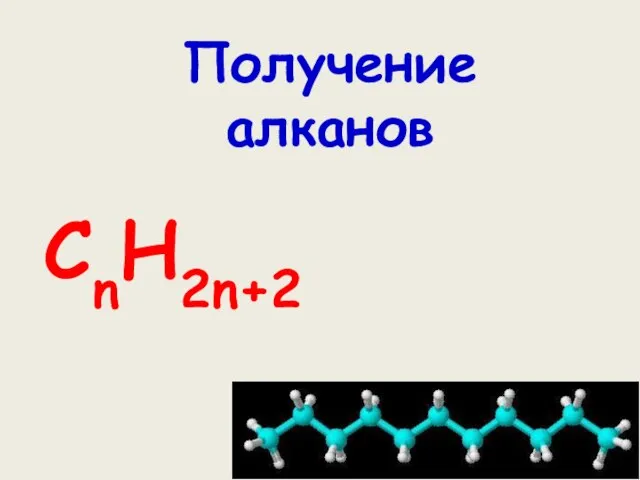 Получение алканов
Получение алканов Вода И её значение
Вода И её значение Алгоритм названия органического соединения
Алгоритм названия органического соединения Лекция 1 Основные понятия и законы химии
Лекция 1 Основные понятия и законы химии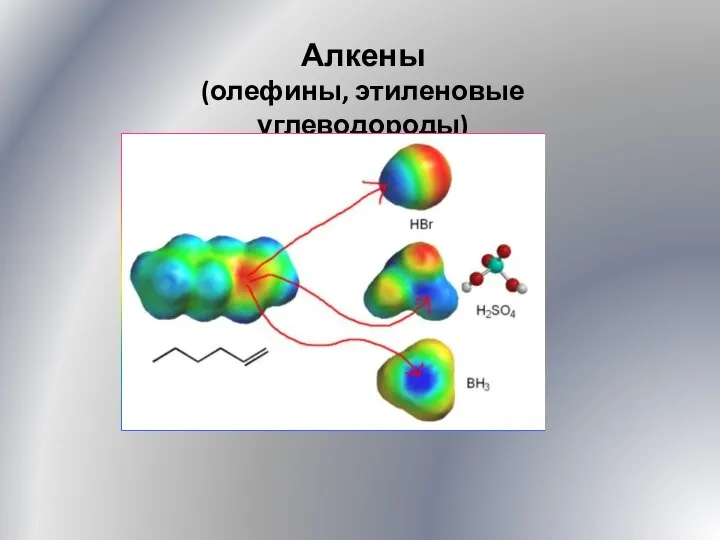 Алкены. Олефины, этиленовые углеводороды. (Лекция 5)
Алкены. Олефины, этиленовые углеводороды. (Лекция 5) DOC-20221011-WA0003
DOC-20221011-WA0003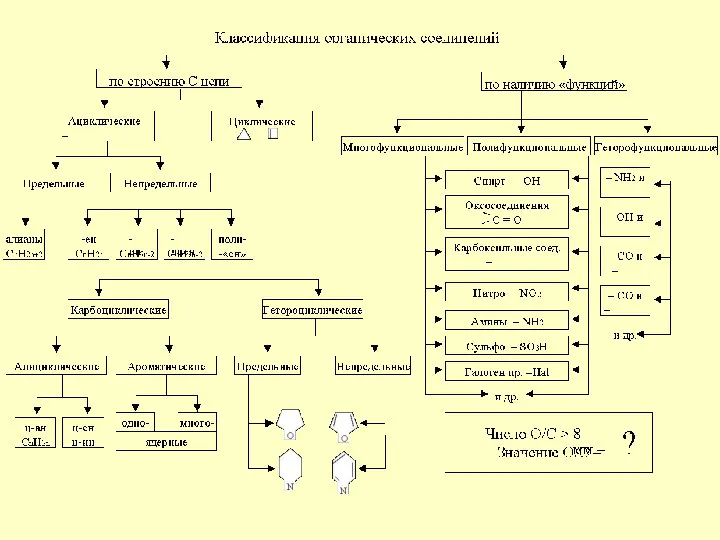 Классификация органических соединений
Классификация органических соединений Вода как хладагент (R718)
Вода как хладагент (R718)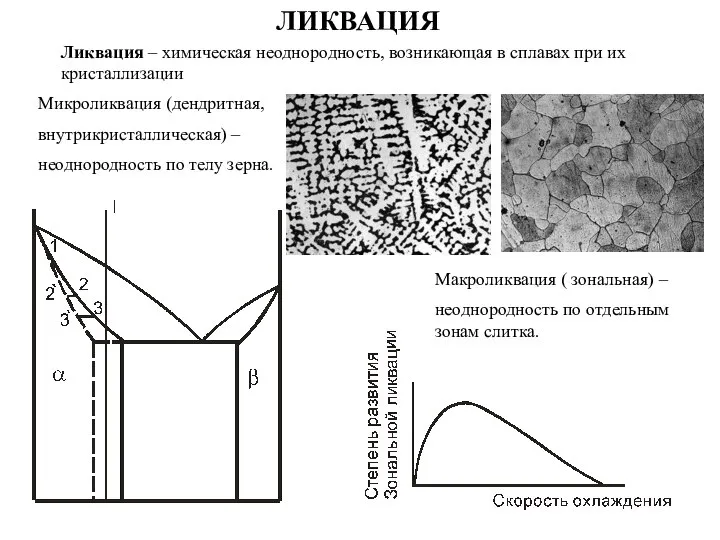 Ликвация. Микроликвация
Ликвация. Микроликвация Основные химические понятия и законы химии. (Часть 1)
Основные химические понятия и законы химии. (Часть 1) Анализ процесса гальванического нанесения рения. Поиск альтернативных способов нанесения рения
Анализ процесса гальванического нанесения рения. Поиск альтернативных способов нанесения рения Межкристаллитная коррозия МКК
Межкристаллитная коррозия МКК Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Моделирование деформаций углеродных слоёв при функционализации технического углерода
Моделирование деформаций углеродных слоёв при функционализации технического углерода Электрохимия. Предмет и задачи электрохимии. Теория растворов электролитов
Электрохимия. Предмет и задачи электрохимии. Теория растворов электролитов მეტალები
მეტალები Альдегиды
Альдегиды Получение, свойства и применение алкенов
Получение, свойства и применение алкенов