Слайд 2Цель: Донести до студента роль биологических соединений и понятие о металлоферментах.
План:

1. Биокомплексы металлов.
2. Металлопротеины.
3. Металлоферменты.
Слайд 3Введение.
Роль комплексных соединений в жизнедеятельности живых организмов огромна.
Организм представляет систему,

состоящую из множества комплексообразователей и лигандов, с определенным соотношением между ними.
Нарушение баланса компонентов (металло-лигандного гомеостаза) приводит к развитию патологических состояний. Поэтому изучение процессов взаимодействия «металл–лиганд» является ключом к поиску новых лекарственных средств.
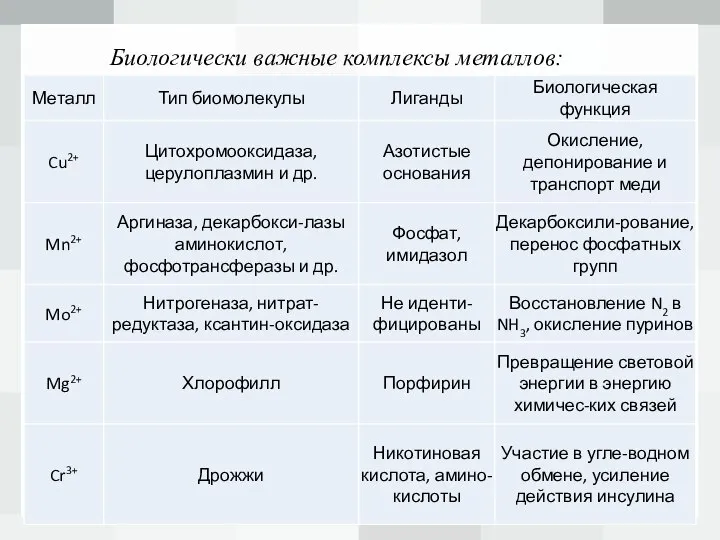
В процессах обмена веществ фундаментальную роль играет биокатализ, в котором принимают участие металлоферменты, представляющие собой биокомплексы Fe, Co, Mn, Zn, Мо, Mg, Сu, Сr.
Слайд 4 Биокомлексы металлов.
Биокомплексы металлов — это координационные соединения, выполняющие в организме определенные биохимические функции,

в соответствии с которыми их условно можно подразделить на транспортные (ионо-форы) и аккумуляторные формы (накопители), а также активаторышиерт-ных молекул или биокатализаторов.
Слайд 5 Можно утверждать, что в биосистемах свободных ионов металлов практически нет, так как они

или гидролизуются, или находятся в составе координационных соединений. Чаще всего -элементы участвуют в биохимических реакциях в составе комплексов с лигандами — аминокислотами, пептидами, белками, гормонами, нуклеиновыми кислотами и т. д.
Наиболее распространенные металлоферменты, такие, как карбоангидраза, ксантинооксидаза, цитохромы и др., представляют собой биокомплексы металлов. Простетические группы гемоглобина, трансферрина и других сложных белков также представляют собой хелатные комплексы металлов
Слайд 6Биологически важные комплексы металлов:
Слайд 7 Металлопротеин.
К металлопротеинам относят биополимеры, которые, помимо белка, содержат простетическую группу (компонент небелкового

характера), включающую ионы металлов.
Отдельную группу металлопротеинов составляют гемопро-теины, содержащие в качестве простетической группы соединения железа. Одним из важнейших гемопротеинов является гемоглобин. Он состоит из белка (глобина) и комплекса железа с порфирином (гема).
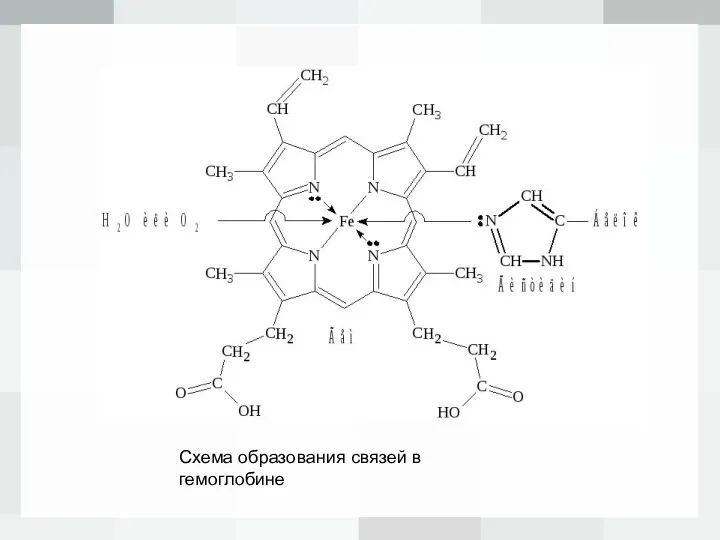
Слайд 8 В геме ион Fe2+ (комплексообразователь), связан с двумя атомами азота, принадлежащими порфириновому

кольцу, ковалентной связью. Координа-ционное число Fe2+ равно шести: в порфириновом комплексе пятое координационное место занимает гистидиновая группа белка, образуя координационую связь атома азота с Fe2+. В отсутствие кислорода шестым лигандом является вода. В случае, когда вода замещается на кислород, образуется оксигемоглобин. Кроме воды и кислорода ион Fe2+ может связывать и некоторые другие лиганды, например, СО, CN и оксиды азота.
Так, с молекулами угарного газа гемоглобин образует карбоксигемоглобин, а с оксидами азота метгемоглобин, содержащий ионы Fe3+. Накопление этих видов гемоглобина в крови приводит к снижению снабжения тканей кровью.
Слайд 9Схема образования связей в гемоглобине
Слайд 10+Токсическое действие большинства тяжелых металлов (ртуть, свинец, таллий и др.) объясняется способностью

ионов этих металлов образовывать прочные комплексы с белками, ферментами и амино-кислотами, В результате подавляется активность ферментов и происходит свертывание белков.
Например, ионы ртути Hg2+ образуют прочные комплексы с белками, имеющими в своем составе SH-группы. Таким образом, ртуть концентрируется в тканях и органах, богатых этими белками, а именно в почках, головном мозге, слизистой оболочке рта.
Свинец удерживается белками эритроцитов, затем поступает в плазму крови в виде комплексов с гамма-глобулином и, наконец, достигает почек, печени и других органов. Свинец также накапли-вается в костной ткани.
Слайд 11 Металлоферменты.
Металлоферменты, или металлоэнзимы — общее собирательное название класса ферментов, для функционирования которых необходимо

присутствие катионов тех или иных металлов. В подобном ферменте могут присутствовать несколько различных ионов металла. Катион металла при этом обеспечивает правильную пространственную конфигурацию активного центраметаллофермента. Примерами металлоферментов являются селен-зависимая монодейодиназа, конвертирующая тироксин в трийодтиронин, или железо-зависимые тканевые дыхательные ферменты. Помимо принадлежности к классу ферментов, металлоферменты принадлежат также к обширному классу металлопротеидов — белков (не обязательно ферментов), в состав которых входят катионы металлов.
Слайд 12 Роль биокомплексов в жизни человека.
Изучение бионеорганических комплексов дает важную информацию

об особенностях их метаболизма и позволяет разрабатывать эффективные способы коррекции заболеваний, связанных с недостатком (или, наоборот, с избытком) тех или иных элементов в человеческом организме.
Применение комплексных соединений в медицине и фармации связано также с их использованием в методах качественного и количественного анализа – в комплексонометрии. Широкое распространение получила комплексонометрия в медико-биологических исследованиях.
Слайд 13 Этот метод необходим для определения в живых организмах кальция, магния и

многих микроэлементов. Комплексонометрия применяется в анализе лекарственного сырья, питьевых, минеральных и сточных вод. В биологии и медицине комплексоны используются не только в аналитических целях, но и в качестве стабилизаторов при хранении крови, так как комплексоны связывают ионы металлов, катализирующих реакции окисления.
Комплексоны применяются также для выведения из организма ионов токсичных металлов (Рb2+, Cd2+ , Hg2+ и др.), радиоактивных изотопов и продуктов их распада.












 Сестринский процесс при гастритах, язвенной болезни желудка и ДПК
Сестринский процесс при гастритах, язвенной болезни желудка и ДПК Проведение антропометрии (рост, вес) ребенку до 1 года
Проведение антропометрии (рост, вес) ребенку до 1 года Сифилис
Сифилис Лечебно-оздоровительная продукция Тибета и России. Российская компания Формула жизни
Лечебно-оздоровительная продукция Тибета и России. Российская компания Формула жизни Спеціальність фармацевт
Спеціальність фармацевт Әр түрлі аурулардағы диетотерапия
Әр түрлі аурулардағы диетотерапия Drebrin controls scar formation and astrocyte reactivity upon traumatic brain injury by regulating membrane trafficking
Drebrin controls scar formation and astrocyte reactivity upon traumatic brain injury by regulating membrane trafficking Болезни печени
Болезни печени Болезни сердца
Болезни сердца Антибиотики. Ципрофлоксацины, амоксициллины
Антибиотики. Ципрофлоксацины, амоксициллины Санация полости рта
Санация полости рта ВИЧ,СПИД. Профилактика
ВИЧ,СПИД. Профилактика Контрактура жевательных мышц
Контрактура жевательных мышц Инфекциялардың табиғи ошақтарының эпидемиологиясы
Инфекциялардың табиғи ошақтарының эпидемиологиясы Проведение зоогигиенических, профилактических и ветеринарно-санитарных мероприятий
Проведение зоогигиенических, профилактических и ветеринарно-санитарных мероприятий Особенности ведения пациенток при сочетании наружного эндометриоза и миомы матки
Особенности ведения пациенток при сочетании наружного эндометриоза и миомы матки Բժշկական էթիկա եվ դեոնտոլոգիա
Բժշկական էթիկա եվ դեոնտոլոգիա Хирургические инструменты
Хирургические инструменты Заболевания пищевода. Ахалазия, эзофагопатия при ссд, варикозное расширение вен пищевода
Заболевания пищевода. Ахалазия, эзофагопатия при ссд, варикозное расширение вен пищевода Микоэкология окружающей среды
Микоэкология окружающей среды Средства, применяемые при заболеваниях пищеварительной системы
Средства, применяемые при заболеваниях пищеварительной системы Корь у детей
Корь у детей Оборудование палаты
Оборудование палаты Экдокринная система и органы иммунной защиты. Контрольные микропрепараты и электроннограммы
Экдокринная система и органы иммунной защиты. Контрольные микропрепараты и электроннограммы Лекция № 9. Учение об инфекции.ppt_
Лекция № 9. Учение об инфекции.ppt_ Витамины
Витамины Стоп ВИЧ/СПИД
Стоп ВИЧ/СПИД Пульпит, периодонтит. Лекция №3
Пульпит, периодонтит. Лекция №3