Содержание
- 2. Зачем фармацевту информация об особенностях дженериков? Исключение претензий со стороны потребителей после приобретения ими в аптеке
- 3. Особенности национальной любви к дженерикам Недостаточная осведомленность населения в области фармакологии и фармакотерапии Низкий уровень разъяснительной
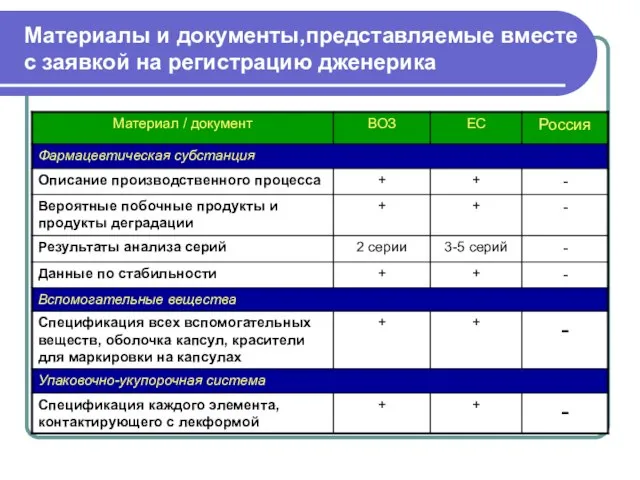
- 4. Материалы и документы,представляемые вместе с заявкой на регистрацию дженерика
- 5. «Засилие» дженериков В Российской Федерации зарегистрировано более 17 000 наименований лекарственных препаратов 78% из них являются
- 6. Примеры сравнения брэндов и дженериков Амлодипин и норваск Амиодарон и кордарон Ренитек и энам Козаар и
- 7. Оригинальный препарат Original (англ.) – первый, новый, истинный, прежде неизвестный, предшествующий, исходный… Новый препарат, произведенный на
- 8. Дженерик Generic (англ.) – общий, родовой, групповой Дже́нерик (иногда — генерик, женерик) —лекарственное средство, которое выпускается
- 9. Критерии сравнения Дженерик содержит то же активное лекарственное вещество (субстанцию), что и оригинальный (патентованный) препарат. Дженерик
- 10. Эквивалентность брэндов и дженериков (требования FDA) Фармацевтически эквивалентные лекарственные препараты содержат одинаковые активные ингредиенты в одинаковой
- 11. Фармацевтическая эквивалентность Фармацевтически эквивалентные лекарственные препараты содержат одинаковые активные ингредиенты в одинаковой лекарственной форме, предназначены для
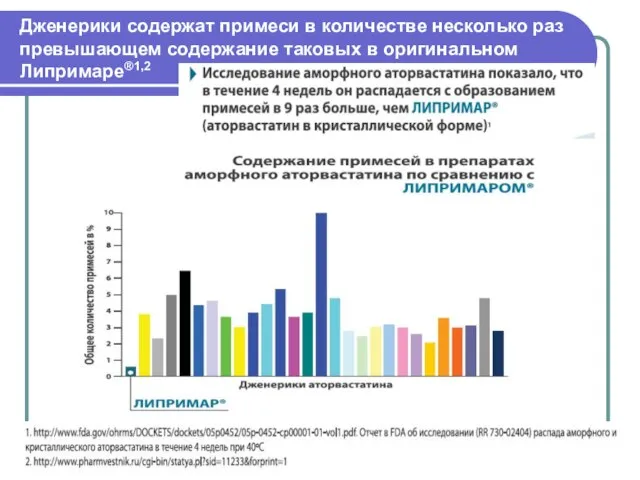
- 12. Дженерики содержат примеси в количестве несколько раз превышающем содержание таковых в оригинальном Липримаре®1,2
- 13. Electronic Orange Book – результаты поиска Периндаприл (Perindapril)– не зарегистрирован Аторвастатин – кодуэт, липитор (PFIZER) Квинаприл
- 14. Рекомендации ВОЗ в отношении биоэквивалентности Биоэквивалентность дженерика следует определять по отношению к оригинальному лекарственному препарату. Если
- 15. Терапевтическая эквивалентность Терапевтически эквивалентными лекарственные препараты могут считаться только в том случае, если они фармацевтически эквивалентны
- 16. Мнение специалиста Марцевич Сергей Юрьевич Профессор, доктор медицинских наук. Профессор кафедры доказательной медицины ФДПОП ММА им
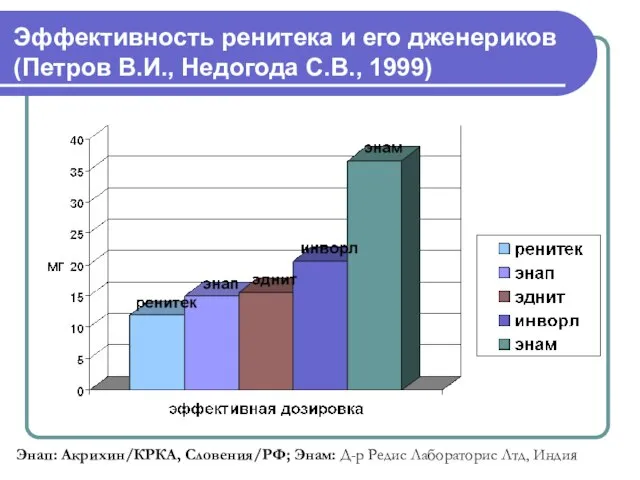
- 17. Эффективность ренитека и его дженериков (Петров В.И., Недогода С.В., 1999) Энап: Акрихин/КРКА, Словения/РФ; Энам: Д-р Редис
- 18. Дженерики: преимущества и недостатки Таблиц взаимозаменяемости дженерических препаратов в РФ не существует. В Интернете можно воспользоваться
- 19. Electronic Orange Book Approved Drug Products with Therapeutic Equivalence Evaluations Current through December 2008** ** In
- 20. Сравнение терапевтической эффективности липримара и его дженериков Эффективная дозировка – от 20 мг/сут Скорость наступления клинических
- 21. при принятии врачом решения о переводе пациента с оригинального препарата на генерический у 2/3 больных возникали
- 22. Мнение Association of American Physicians (основана в 1885 г.) Американская ассоциация врачей не рекомендует в качестве
- 23. Особенности отечественного амлодипина Компания «Pfizer» не передавала лицензию на производство и распространение «Норваска» Действие глобального патента
- 24. Особенности дженериков аторвастатина Компания «Pfizer» не передавала лицензию на производство и распространение «Липримара» Глобальный патент на
- 25. Что общего между ЛИПРИМАРОМ® и его дженериками? Что общего между алмазом и углем?
- 26. Почему все-таки Оригинальный препарат? Оригинальный препарат: Стабильность физико-химических свойств действующего вещества Высококачественные наполнители и оболочка Доказательства
- 27. Спасибо за внимание.
- 28. Е.М. Тареев «Для того, чтобы в наш век лечиться, нужно иметь хорошее здоровье!» Академик Академии медицинских
- 29. иАПФ, зарегистрированные в США (результаты поиска в Electronic Orange Book по “…pril” Беназеприл - 20 Каптоприл
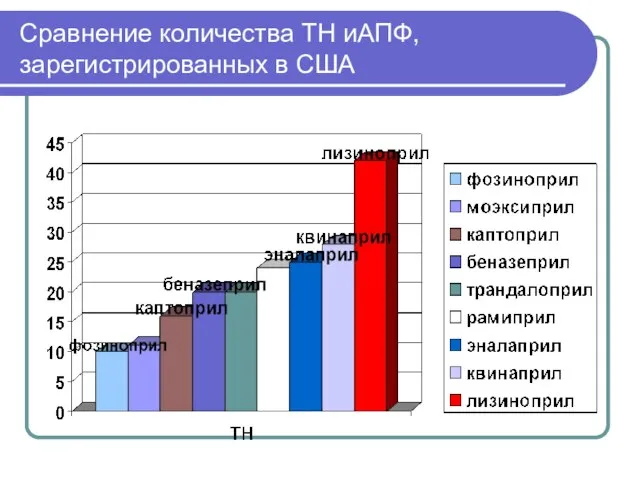
- 30. Сравнение количества ТН иАПФ, зарегистрированных в США
- 32. Скачать презентацию

























 Тема №4 Лекция №4 Нарушения ритма и проводимости. Тыренко.В.В. - 2022
Тема №4 Лекция №4 Нарушения ритма и проводимости. Тыренко.В.В. - 2022 Менингококки
Менингококки Чрескостный остеосинтез верхних конечностей
Чрескостный остеосинтез верхних конечностей Патогенез аритмий. Антиаритмические препараты
Патогенез аритмий. Антиаритмические препараты Биохимия почек
Биохимия почек Первая помощь при ДТП
Первая помощь при ДТП Современные аспекты диагностики и лечения патологии поверхностных тканей глаза. Международный конгресс врачей офтальмологов
Современные аспекты диагностики и лечения патологии поверхностных тканей глаза. Международный конгресс врачей офтальмологов Индивидуальная гигиена полости рта у пациентов с имплантантами
Индивидуальная гигиена полости рта у пациентов с имплантантами Физиология питания. Понятие о микроорганизмах
Физиология питания. Понятие о микроорганизмах Ирумед. Базовая информация. Основные принципы терапии артериальной гипертонии
Ирумед. Базовая информация. Основные принципы терапии артериальной гипертонии Вульвовагенит. Симптомы
Вульвовагенит. Симптомы Жүре және туа пайда болған липидоздар
Жүре және туа пайда болған липидоздар Зачетная работа
Зачетная работа Корь, краснуха
Корь, краснуха Радикулопатии
Радикулопатии Мочевыделительная система
Мочевыделительная система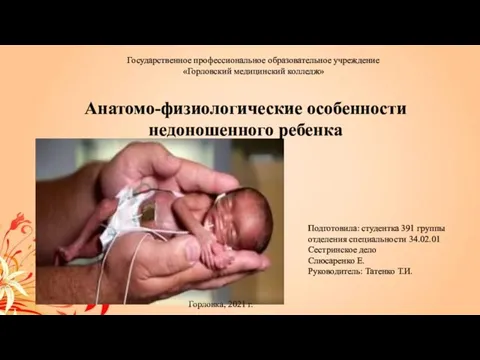 Анатомо-физиологические особенности недоношенного ребенка
Анатомо-физиологические особенности недоношенного ребенка SC FOOD ЖШС-де бұзау трихофитиясын дауалаудағы препараттардың тиімділігі
SC FOOD ЖШС-де бұзау трихофитиясын дауалаудағы препараттардың тиімділігі Основы кардиоваскулярной хирургии
Основы кардиоваскулярной хирургии Отдаленные последствия АРТ-терапии у детей, рожденных от ВИЧ-инфицированных матерей в роддоме
Отдаленные последствия АРТ-терапии у детей, рожденных от ВИЧ-инфицированных матерей в роддоме Сокращения в медицине
Сокращения в медицине Метаболические яды
Метаболические яды Сдача анализа кала
Сдача анализа кала Өкпе артериясының тромбоэмболиясы. Терең көктамырлар тромбозы
Өкпе артериясының тромбоэмболиясы. Терең көктамырлар тромбозы Осложнения сахарного диабета. Часть 3
Осложнения сахарного диабета. Часть 3 Хранение товаров аптечного ассортимента 2021-2022 год
Хранение товаров аптечного ассортимента 2021-2022 год Ботулизм. Виды ботулизма
Ботулизм. Виды ботулизма Опухоли пищевода
Опухоли пищевода