Содержание
- 2. Жоспар 1. Нюрнберг кодексі2. Хельсинг декларациясы3. Бельмонт есебі4.АҚШ федералды заңдар Кодексі5. Гармонизация бойынша халықаралық конференция. 6.
- 3. Глоссарий Ақпараттандырылған келісім- зеттеудің барлық аспектілерімен танысқаннан кейінгі науқастың өз еркімен келісімімен зеттеуге катысуы.Хаттама- зерттеуді үйымдастырудың
- 4. Этникалық қағидалар- адамның денсаулығы саласындағы адамгершілікке бағытталған қағидалар жиынтығы. Дәрігер этикасы- дәрігер мен оның науқастары және
- 5. Нюрнберг КодексіӘлеуметтік маңызды жалпы өркениеттік мәселелер деңгейінде ғалымдардың алдына қойылған этикалық және әлеуметтік жауапкершілік мәселесі қойған
- 6. Нюрнберг үрдісі. ТарихДәрігерлерге қатысты Нюрнберг үрдісі 1946 жылдың 9 желтоқсанынан 1947 жылдың 20 тамызы жүрді. Он
- 7. Дәрігерлерді айыптаудың негізгі пункттері Мәжбүрлі медициналық тәжірибелер Хирттың анатомиялық коллекциясы үшін тұтқындарды өлтіру немесе мәжбүрлі эвтаназия
- 8. Нюрнберг кодексінің 10 ережелері 1.Ерікті ақпараттандырылған келісім болуы керек 2.Тәжірибе адамзат игілігі үшін болуы керек ,
- 9. 6.Пайдаға қарсы тәуекел7.Ғылыми зерттеулерге қатысушыларды мүгедектік немесе өлімнен қорғау керек8.Адамдарға тәжірибе тек ғылыми білікті персоналмен жүргізілуі
- 10. Нюрнберг кодексінде қалыптасқан қағидаттар адамдарға медициналық зерттеулер жүргізу саласындағы көптеген халықаралық және ұлттық заңнамалық актілер үшін
- 11. 1964: Хельсинке декларациясы* 1982: Адамдарға Биомедициналық Зерттеулер Үшін Халықаралық Ережелер* 1991: Эпидемиологиялық Зерттеулерді Этикалық Бағалау Үшін
- 12. Қорытындылар Нюрнберг трибуналы, жоғарғы мемлекеттік шенеуніктердің халықаралық сотқа соттау прецедентін құрып, ортағасырлық принципін «Патшалар тек Құдайға
- 13. Хельсинки декларациясының даму тарихы Адамзат тарихындағы алғашқы халықаралық Кодекстің маңыздылығы кезінде Нюрнберг кодексі бейбіт уақытта адамдарға
- 14. Дүниежүзілік медициналық қауымдастық (ВМА) субъект ретінде адамның қатысуымен медициналық зерттеулер, оның ішінде биологиялық материалдарды немесе олар
- 15. Декларацияның қайта қаралуы 18-ші Бас Ассамблея ВМА, Хельсинки, Финляндия, 1964 ж. маусым айында қабылданды.,өзгерістер енгізілді:ВМА 29-шы
- 16. Хельсинская декларация "Руководящие рекомендации для врачей, проводящих медико-биологические исследования на людях». Носит рекомендательный характер. Основные положения
- 17. Основные принципы: 1. Научная обоснованность исследований и экспериментов 2. Протокол эксперимента 3.Квалификация персонала 4. Важность эксперимента
- 18. 7. Сравнение опасности и ожидаемой пользы 8. Точность результатов 9. Информированность участника эксперимента, добровольность согласия 10.Исключение
- 19. Критерий этичности «Кодекс» – наличие согласия испытуемого на участие в исследовании. «Декларация» – научная обоснованность исследования.
- 20. Информированное согласие «Кодекс» определяет наличие согласия испытуемого на участие в исследовании, оно должно даваться свободно и
- 21. Критерий добровольного согласия "Кодекс" не допускает возможности проведения экспериментов с участием лиц, которые по тем или
- 22. Требования к научным публикациям Гарантия точности публикуемых результатов проведенного исследования Соответствие проводимых экспериментов принципам «Декларации» Во
- 23. Клинические медицинские исследования 1. В процессе лечения врач должен быть свободен в выборе методов диагностики и
- 24. Клиникалық емес медико-биологиялық зерттеулер 1. Дәрігер адамдарға таза ғылыми( тәжірибелік емес) зерттеу жүргізгенде ,олардың өмірі мен
- 25. Бельмонттың есебі 1972 жылы қоғам арасында 1932 жылдан 1972 жылға дейін АҚШ-тың оңтүстігінде орын алған Таскегю
- 26. 1972 жылы Журналистік тергеу жүргізілді, оның нәтижелері Нью-Йорк таймс және Вашингтон Стар басып шығарылды да қарқынды
- 27. 1979 жылдың сәуірінде АҚШ- тың денсаулық сақтау , білім беру және әлеуметтік қамтамасыз ету департаменті ресми
- 28. Есеппен этикалық принциптер белгіленген: - адамға құрмет - пайда - әділдік
- 29. Үйлестіру жөніндегі халықаралық конференция 1960-1970 жылдары көптеген елдер жаңа медициналық препараттар мен медициналық мақсаттағы бұйымдардың қауіпсіздігі,
- 30. В 1990-х годах представители США, Японии, Европы встретились для организации Конференции для стандартизации процесса по созданию,
- 31. GCP – это международный этический и научный стандарт качества по планированию, выполнению, документированию и сообщениям о
- 32. Конвенция Совета Европы “О правах человека и биомедицине” Юридическим документом, регулирующим биомедицинские исследования, является Конвенция Совета
- 33. Основные положения конвенции Запрещается проведение исследований на человеческих эмбрионах Дополнительный протокол 1998 г. Запрещает клонирование человека
- 34. Запрет выбора пола будущего ребенка за исключением случаев, когда это делается для предотвращения наследования им заболевания,
- 35. Закон РК «Об охране здоровья граждан» Статья 31. Проведение доклинических исследований и медико-биологических экспериментов, клинических испытаний,
- 36. Закон РК «О лекарственных средствах» Статья 19. Клинические исследования и (или) испытания фармакологических и лекарственных средств
- 37. Закон РК «О лекарственных средствах» Статья 20. Права пациента, участвующего в клинических исследованиях и (или) испытаниях
- 38. 3. Пациент имеет право отказаться от участия в клинических исследованиях и (или) испытаниях фармакологического и лекарственного
- 39. 2) беременных женщинах, за исключением случаев, если проводятся клинические испытания лекарственных средств, предназначенных для беременных женщин,
- 41. Скачать презентацию






































 Расслабляющий массаж для ног
Расслабляющий массаж для ног Уход за умирающим больным
Уход за умирающим больным Система здравоохранения. Организация медицинской помощи
Система здравоохранения. Организация медицинской помощи Рекомендации по профилактике новой коронавирусной инфекции (COVID-19) в предприятиях торговли
Рекомендации по профилактике новой коронавирусной инфекции (COVID-19) в предприятиях торговли Роль сказки при работе в семейном консультировании
Роль сказки при работе в семейном консультировании Тепловой удар
Тепловой удар Анатомия лица
Анатомия лица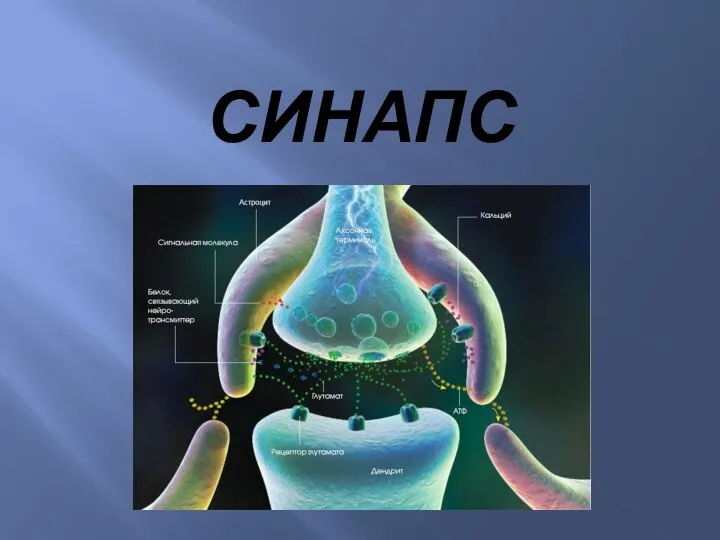 Синапс. Ультраструктура нервно-мышечного синапса
Синапс. Ультраструктура нервно-мышечного синапса Умные системы повсеместного здравоохранения: исследования и перспективы
Умные системы повсеместного здравоохранения: исследования и перспективы Направление медицинского туризма внутри и вне РФ
Направление медицинского туризма внутри и вне РФ Цифровая флюорография, назначение, устройство аппарата
Цифровая флюорография, назначение, устройство аппарата Профилактика рака молочной железы
Профилактика рака молочной железы Болезнь Альцгеймера
Болезнь Альцгеймера Биохимия крови
Биохимия крови Принципы лечения РУ и ЛУ туберкулеза
Принципы лечения РУ и ЛУ туберкулеза Основы хирургии опухолей
Основы хирургии опухолей Բժշկական էթիկա եվ դեոնտոլոգիա
Բժշկական էթիկա եվ դեոնտոլոգիա General arthrosyndesmology The joints of trunk
General arthrosyndesmology The joints of trunk Родовые травмы
Родовые травмы Формулы расчёта оптической силы интраокулярных линз
Формулы расчёта оптической силы интраокулярных линз Оказание помощи при попадании инородного тела в дыхательные пути
Оказание помощи при попадании инородного тела в дыхательные пути Алгоритм диагностики и оказания неотложной помощи при отравлении и абстинентном синдроме, вызванных употреблением этанола
Алгоритм диагностики и оказания неотложной помощи при отравлении и абстинентном синдроме, вызванных употреблением этанола 2019 ESC Guidelines for the management of patients with supraventricular tachycardia
2019 ESC Guidelines for the management of patients with supraventricular tachycardia Меры социальной поддержки медицинских работников Липецкой области
Меры социальной поддержки медицинских работников Липецкой области Амилоидоз сердца
Амилоидоз сердца Стойкая нетрудоспособность. Основы медико-социальной экспертизы
Стойкая нетрудоспособность. Основы медико-социальной экспертизы Айырша бездің топографиялық анатомиясы. Балалардағы ерекшеліктері
Айырша бездің топографиялық анатомиясы. Балалардағы ерекшеліктері Синдром Вольфа-Паркинсона-Уайта донорского сердца и катетерная аблация пучка Кента после ортотопической трансплантации сердца
Синдром Вольфа-Паркинсона-Уайта донорского сердца и катетерная аблация пучка Кента после ортотопической трансплантации сердца