Содержание
- 2. Врожденный иммунитет (ВИ) (1) возникает в филогенезе (историческом формировании вида), (2) зависит от конституции и генетических
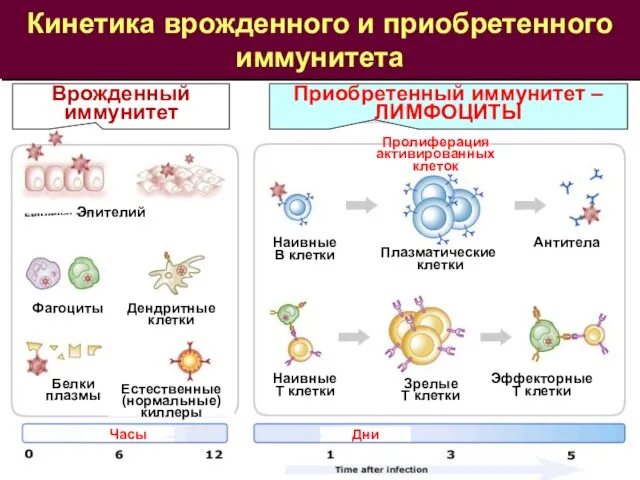
- 3. Кинетика врожденного и приобретенного иммунитета Врожденный иммунитет Приобретенный иммунитет – ЛИМФОЦИТЫ Часы Дни Эпителий Фагоциты Дендритные
- 4. Факторы Врожденного Иммунитета (1) Физические (механические) барьерные факторы: кожа, слизистые РТ, ЖКТ, Моче- Полового Тракта, нормальная
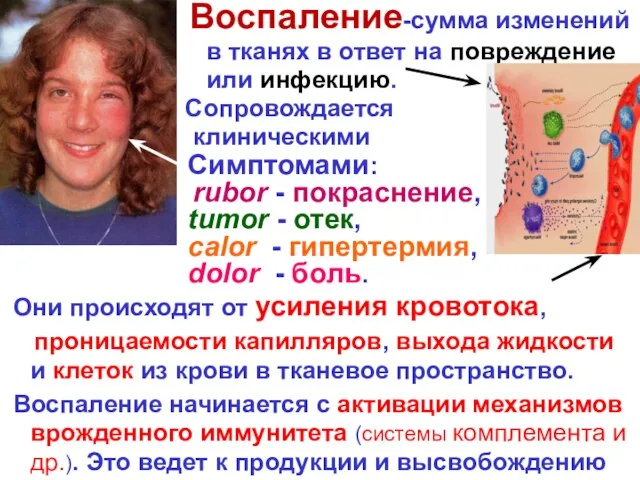
- 5. Воспаление-сумма изменений в тканях в ответ на повреждение as a reaction или инфекцию. Сопровождается клиническими Симптомами:
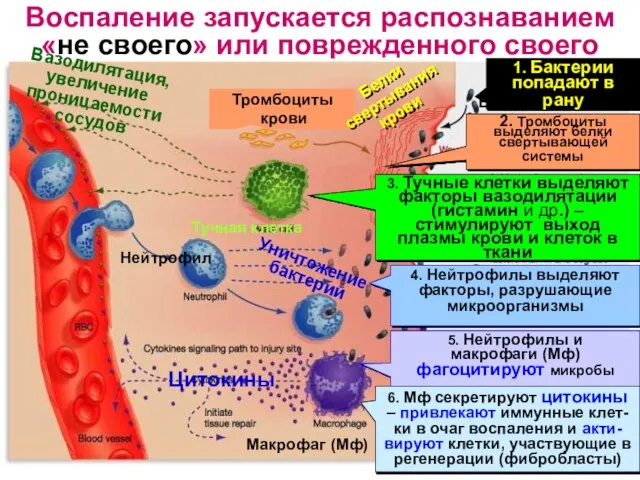
- 6. Воспаление запускается распознаванием «не своего» или поврежденного своего Тромбоциты крови Тучная клетка Нейтрофил Макрофаг (Мф) Цитокины
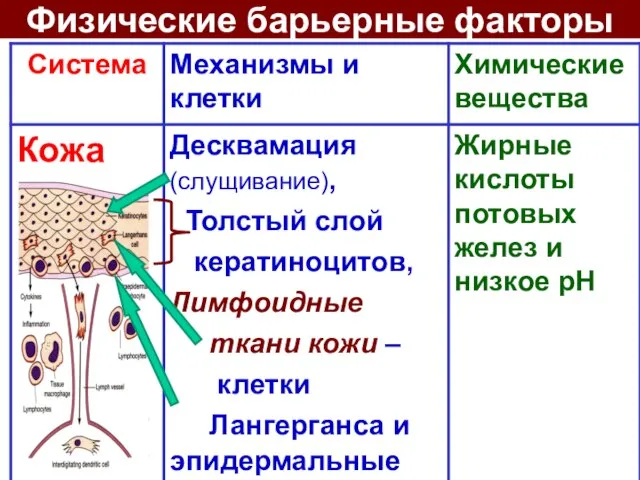
- 7. Физические барьерные факторы
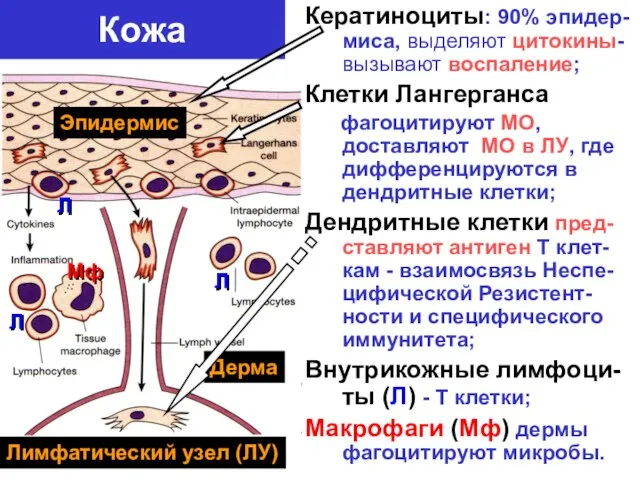
- 8. Кожа Кератиноциты: 90% эпидер-миса, выделяют цитокины- вызывают воспаление; Клетки Лангерганса фагоцитируют МО, доставляют МО в ЛУ,
- 9. Микрофлора тела человека E. coli
- 10. Физические барьерные факторы
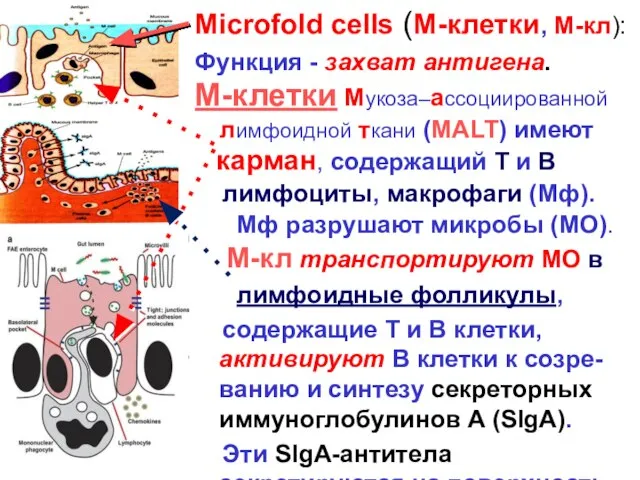
- 11. Microfold cells (M-клетки, М-кл): Функция - захват антигена. M-клетки Мукоза–ассоциированной лимфоидной ткани (MALT) имеют карман, содержащий
- 12. Комплемент: важный бактерицидный компонент врожденного иммунитета. Представляет собой систему белков (фракций), состоящую из более чем 26
- 13. Система Комплемента (Ск) - Содержит 9 главных компонентов – C1- C9, компоненты В, D, P и
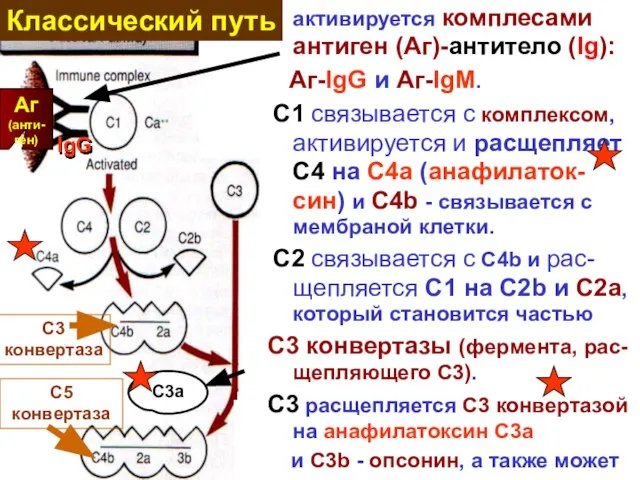
- 14. активируется комплесами антиген (Аг)-антитело (Ig): Aг-IgG и Aг-IgM. C1 связывается с комплексом, активируется и расщепляет C4
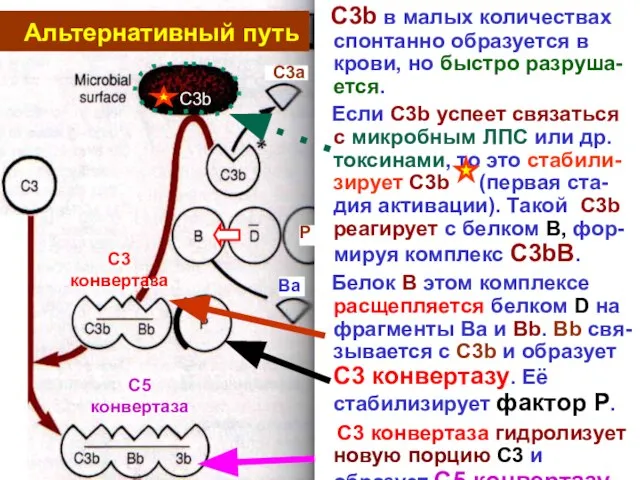
- 15. C3b в малых количествах спонтанно образуется в крови, но быстро разруша-ется. Если C3b успеет связаться с
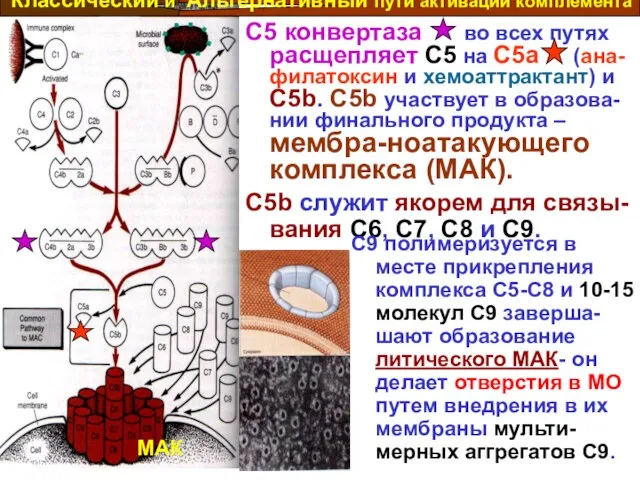
- 16. C5 конвертаза во всех путях расщепляет C5 на C5a (ана-филатоксин и хемоаттрактант) и C5b. C5b участвует
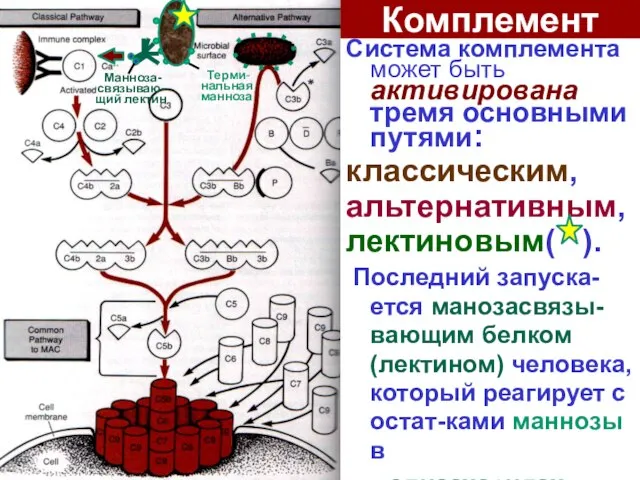
- 17. Комплемент Система комплемента может быть активирована тремя основными путями: классическим, aльтернативным, лектиновым( ). Последний запуска-ется манозасвязы-вающим
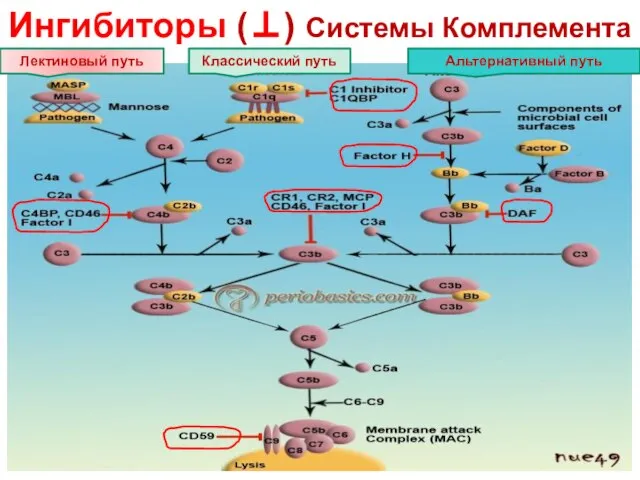
- 18. Ингибиторы (⊥) Системы Комплемента Лектиновый путь Классический путь Альтернативный путь
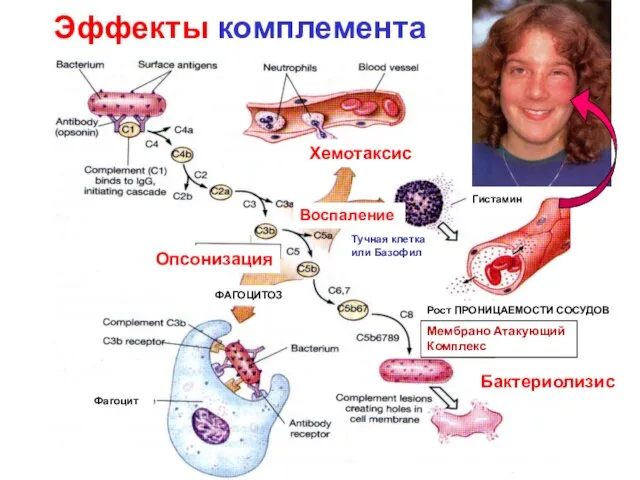
- 19. Эффекты комплемента Хемотаксис Воспаление Бактериолизис Опсонизация Мембрано Атакующий Комплекс Тучная клетка или Базофил Гистамин Фагоцит ФАГОЦИТОЗ
- 20. Интерферон (ИФН) Интерфероны – гетерогенная группа видоспецифичных гликопротеидов, синтезируемых животными и человеком. Они подразделяются на три
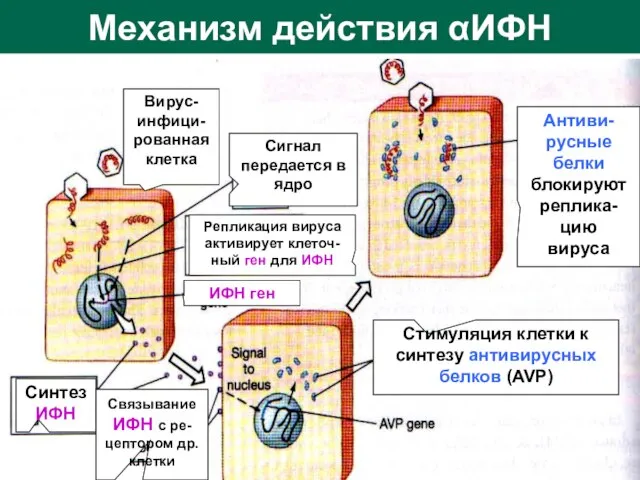
- 21. Механизм действия αИФН Вирус-инфици- рованная клетка Сигнал передается в ядро Репликация вируса активирует клеточ-ный ген для
- 22. Фагоциты – Клетки врожденного иммунитета Фагоцитоз (внутриклеточная инактивация МО)- эффективный механизм уничтожения бактерий. Клетки, участвующие в
- 23. Хемокины (ХК) Макрофаги и Микрофаги (Мф) мигрируют в зараженный участок тела под действием хемокинов. ХК -
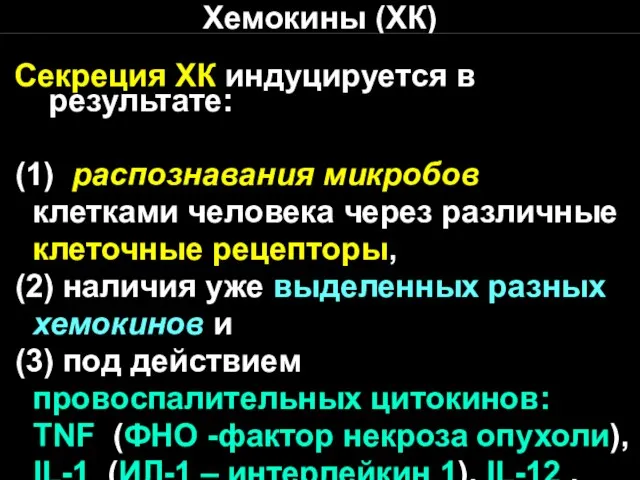
- 24. Хемокины (ХК) Секреция ХК индуцируется в результате: (1) распознавания микробов клетками человека через различные клеточные рецепторы,
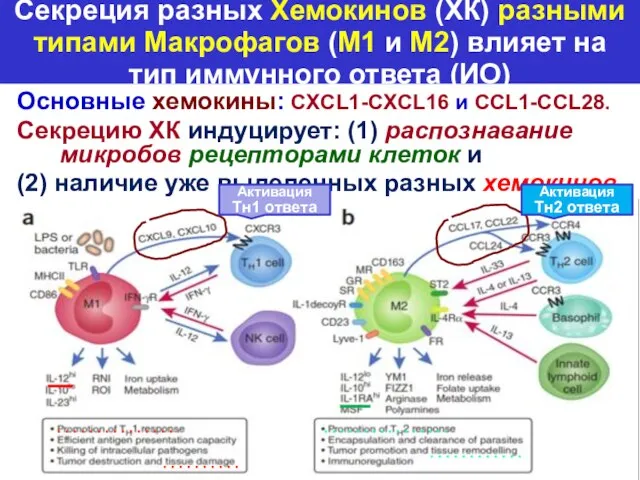
- 25. Секреция разных Хемокинов (ХК) разными типами Макрофагов (M1 и M2) влияет на тип иммунного ответа (ИО)
- 26. Распознавание микробов и собственных поврежденных клеток Системы врожденного иммунитета распознают МОЛЕКУЛЯРНЫЕ ШАБЛОНЫ (ПАТТЕРНЫ): Патоген-ассоциированные молекулярные шаблоны
- 27. Распознавание микробов и собственных поврежденных клеток Системы врожденного иммунитета распознают 2. Повреджение-ассоциированные молекулярные шаблоны (ПАМШ) или
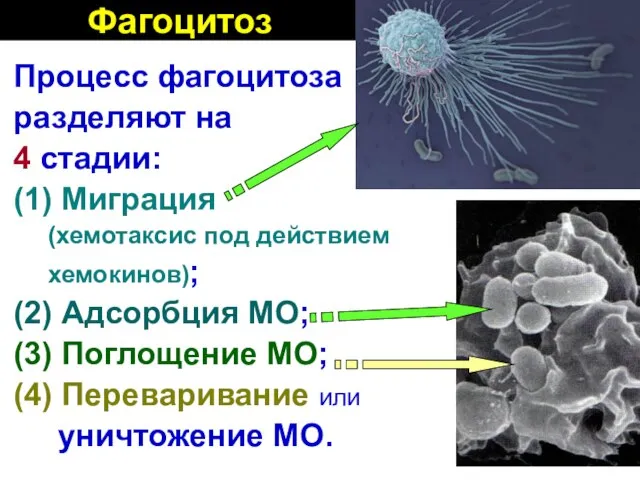
- 28. Фагоцитоз Процесс фагоцитоза разделяют на 4 стадии: (1) Миграция (хемотаксис под действием хемокинов); (2) Адсорбция МО;
- 29. Миграция Фагоциты двигаются амебоидно- мигрируют в и из кровеносных сосудов (диапедез) под действием хемоаттрактантов (хемокинов CCL
- 30. Миграция При миграции фагоциты (Мф) адгезируются на эндотелий в очаге инфекции за счет взаимодействия Интегринов, белков
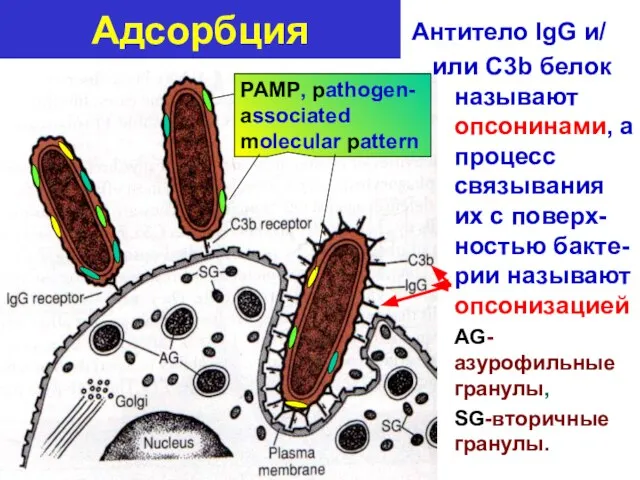
- 31. Адсорбция (адгезия) –идет за счет прикрепления рецепторов фагоцитов к (1) патоген-связанным молекулярлярным шаблонам (PAMP, pathogen-associated molecular
- 32. Адсорбция Антитело IgG и/ или C3b белок называют опсонинами, а процесс связывания их с поверх-ностью бакте-рии
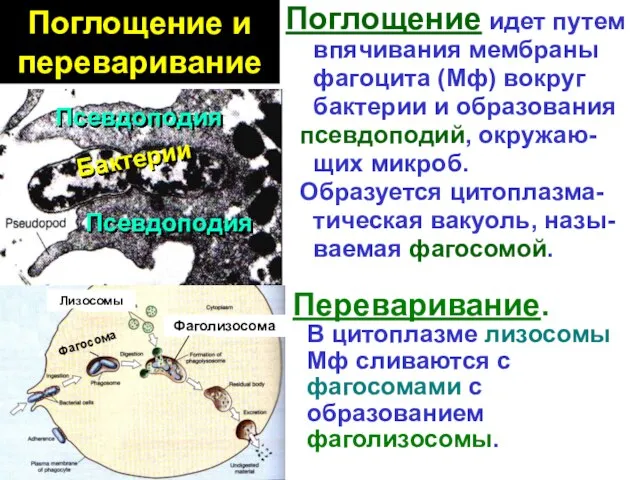
- 33. Поглощение и переваривание Поглощение идет путем впячивания мембраны фагоцита (Мф) вокруг бактерии и образования псевдоподий, окружаю-
- 34. Перева- ривание Лизис бактерий идет 2 путями. Кислород-зависимый – за счет кислородного взрыва – NADPH- зависимой
- 35. Естественные киллеры (ЕК,NK) – не фагоцити-рующие клетки-убийцы врожденного иммунитета - Лимфоцитоподобные клетки. Разрушают вирус-инфицированные и опухо-левые
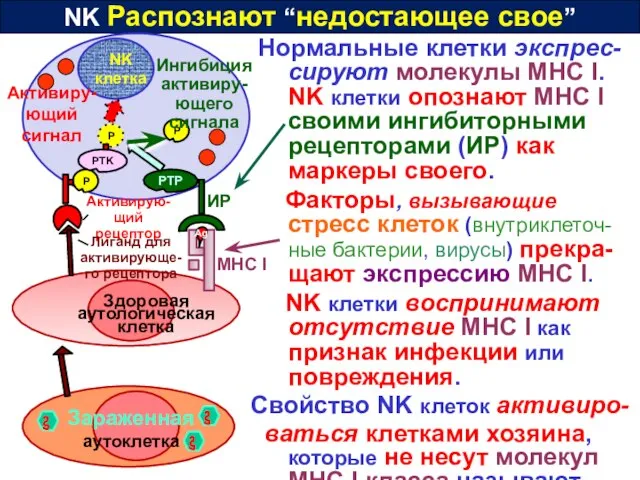
- 36. NK Распознают “недостающее свое” Нормальные клетки экспрес-сируют молекулы MHC I. NK клетки опознают MHC I своими
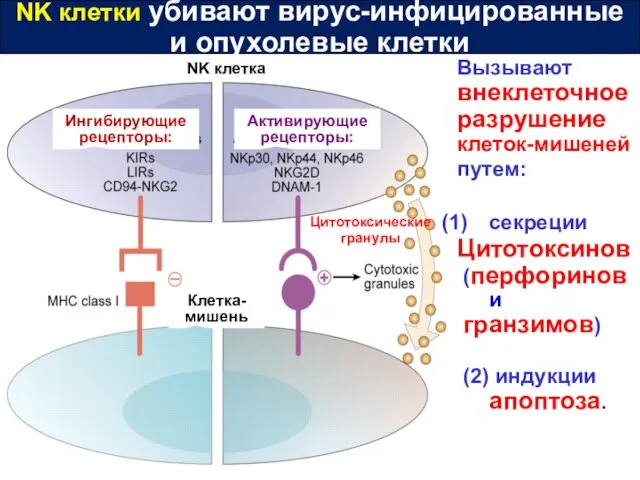
- 37. NK клетки убивают вирус-инфицированные и опухолевые клетки Клетка-мишень NK клетка Ингибирующие рецепторы: Активирующие рецепторы: Цитотоксические гранулы
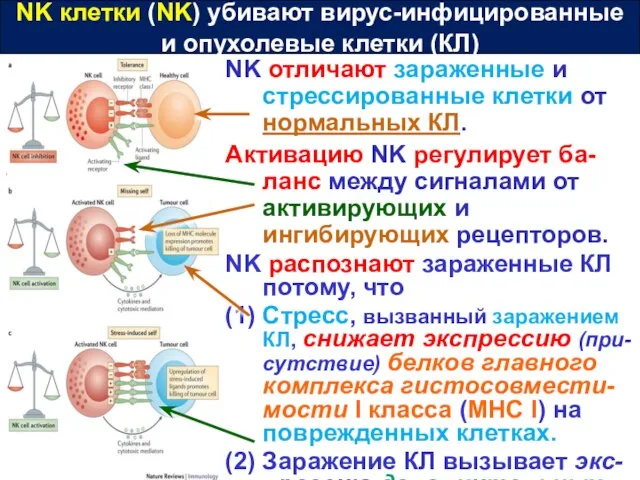
- 38. NK клетки (NK) убивают вирус-инфицированные и опухолевые клетки (КЛ) NK отличают зараженные и стрессированные клетки от
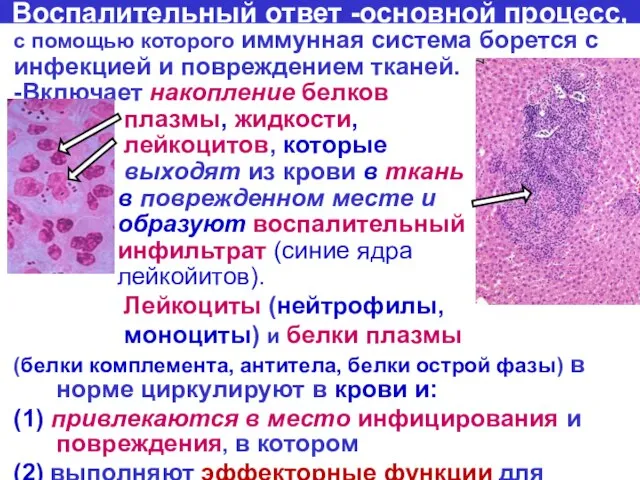
- 39. Воспалительный ответ -основной процесс, с помощью которого иммунная система борется с инфекцией и повреждением тканей. -Включает
- 40. Развитие воспалительного ответа можно разделить на 7 этапов: (1) Начало воспаления - зависит от первичного распознавания
- 41. Начало воспаления. Первичное распознава-ние “не своего” и своих поврежденных клеток 1. Системы врожденного иммунитета - компле-
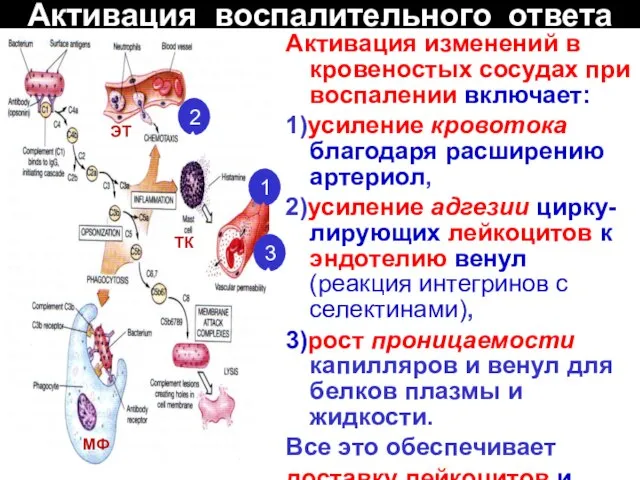
- 42. Активация воспалительного ответа Активация изменений в кровеностых сосудах при воспалении включает: 1)усиление кровотока благодаря расширению артериол,
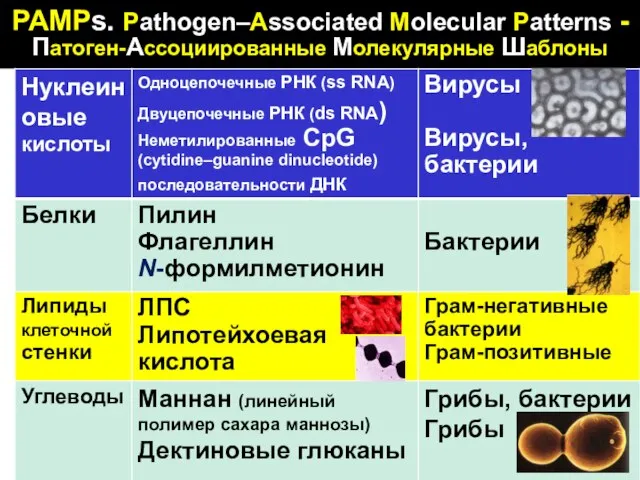
- 43. PAMPs. Pathogen–Associated Molecular Patterns - Патоген-Ассоциированные Молекулярные Шаблоны
- 44. DAMPs. Damage-Associated Molecular Patterns –
- 45. Распознавание микробов и поврежденных клеток системой врожденного иммунитета Клеточные рецепторы для PAMPs и DAMPs называют Паттерн
- 46. PRR, клеточные Pattern-Recognition Receptors
- 47. PRRs, Toll-like рецепторы (TLRs)
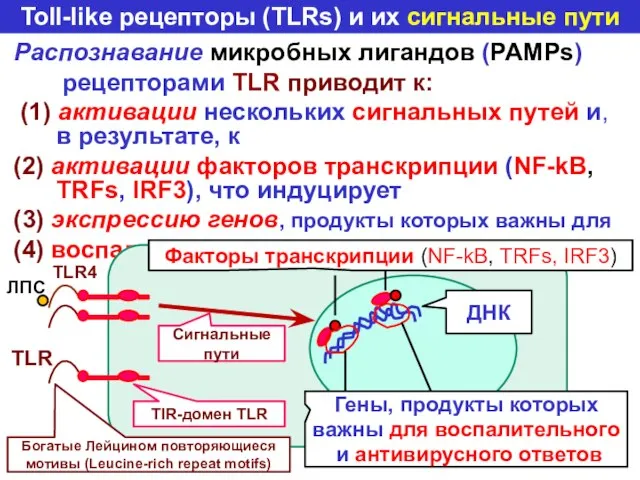
- 48. Toll-like рецепторы (TLRs) и их сигнальные пути Распознавание микробных лигандов (PAMPs) рецепторами TLR приводит к: (1)
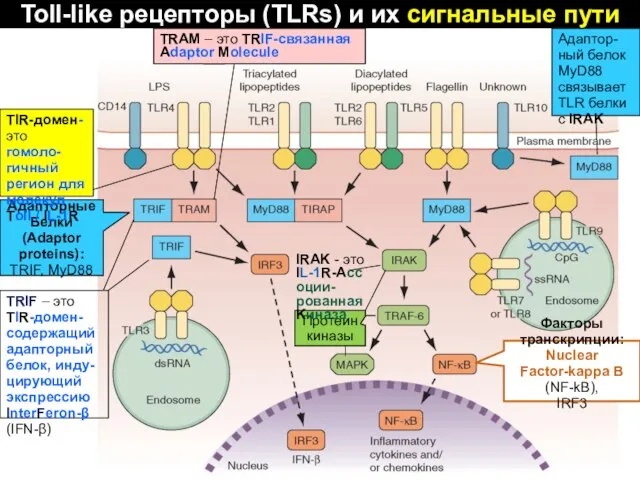
- 49. Toll-like рецепторы (TLRs) и их сигнальные пути Факторы транскрипции: Nuclear Factor-kappa B (NF-kB), IRF3 Адапторные Белки
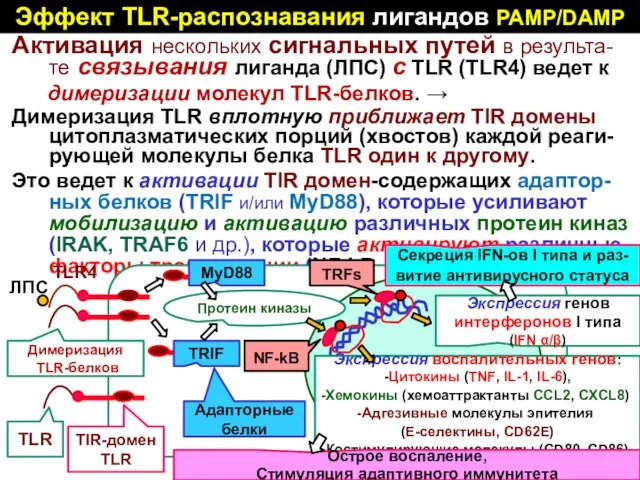
- 50. Эффект TLR-распознавания лигандов PAMP/DAMP Aктивация нескольких сигнальных путей в результа-те связывания лиганда (ЛПС) с TLR (TLR4)
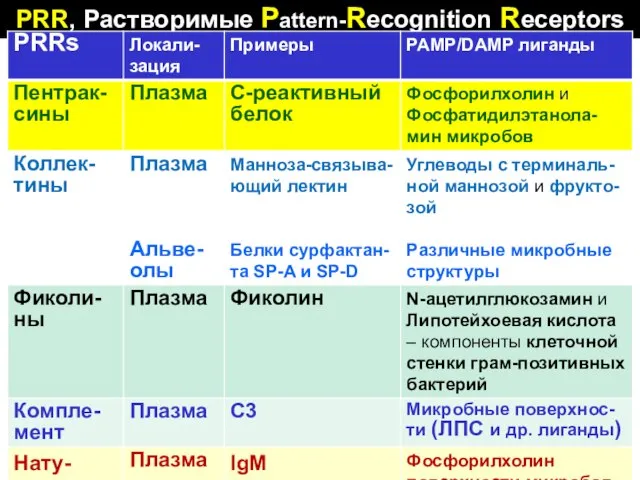
- 51. PRR, Растворимые Pattern-Recognition Receptors
- 52. Aктивация воспаления Провоспалительными Цитокинами Все обратимые изменения в кровенос-ных сосудах в инфицированных тканях (усиление кровотока из
- 53. Главные провоспалительные цитокины
- 55. Скачать презентацию























 Асқазан рагы
Асқазан рагы Ревматоидный артрит
Ревматоидный артрит Медицинская помощь при бесплодии. Программа Аңсаған сәби
Медицинская помощь при бесплодии. Программа Аңсаған сәби Классификация анемий
Классификация анемий Сестринский уход. Документация к сестринскому уходу
Сестринский уход. Документация к сестринскому уходу Очищение организма
Очищение организма Гигиена питания
Гигиена питания Физиотерапия при реабилитации коленного сустава
Физиотерапия при реабилитации коленного сустава Принципы лечения хирургической инфекции
Принципы лечения хирургической инфекции Limfoscyntygrafia
Limfoscyntygrafia Поддерживающая терапия в период химиотерапии
Поддерживающая терапия в период химиотерапии Гиперактивный ребенок
Гиперактивный ребенок Неорганические вещества в медицине
Неорганические вещества в медицине Понятие риска и общие аспекты использования методологии риска в системах СГМ и управления санитарно-эпидемиологической ситуацией
Понятие риска и общие аспекты использования методологии риска в системах СГМ и управления санитарно-эпидемиологической ситуацией akro
akro Депрессия. Причины возникновения депрессии
Депрессия. Причины возникновения депрессии Светолечение (син. фототерапия, фотохромотерапия)
Светолечение (син. фототерапия, фотохромотерапия) Влияние современных технологий на здоровье детей и подростков
Влияние современных технологий на здоровье детей и подростков Методы культивирования и выделения чистых культур аэробов
Методы культивирования и выделения чистых культур аэробов Акромегалия. Причины возникновения и механизмы развития
Акромегалия. Причины возникновения и механизмы развития Анализ соблюдения санитарно-эпидемиологического режима в операционном блоке хирургического отделения
Анализ соблюдения санитарно-эпидемиологического режима в операционном блоке хирургического отделения Preserve the canal anatomy
Preserve the canal anatomy Метод исследования артериальных сосудов
Метод исследования артериальных сосудов Пломбировочные материалы для временных пломб
Пломбировочные материалы для временных пломб Dexamethasonum. Фармакологическая группа: глюкокортикоидные гормоны
Dexamethasonum. Фармакологическая группа: глюкокортикоидные гормоны Расстройство речи, эмоции, воли, двигательные расстройства
Расстройство речи, эмоции, воли, двигательные расстройства Примеры ЭКГ
Примеры ЭКГ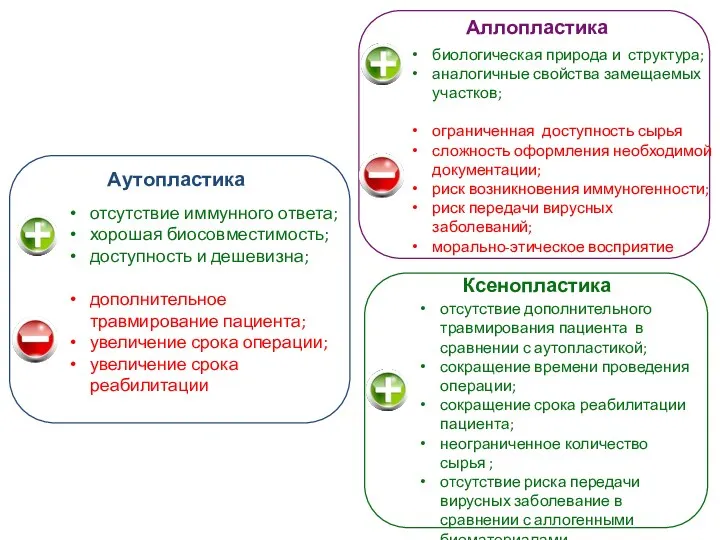 Виды биоматериалов. Аллопластика, аутопластика, ксенопластика
Виды биоматериалов. Аллопластика, аутопластика, ксенопластика