Слайд 2MICROBIOLOGIA ŞI DIAGNOSTICUL DE LABORATOR AL DIFTERIEI
DIFTERIA – toxiinfecţie acută, caracterizată printr-o

angină pseudo-membranoasă (greaca: diphthera – pereche de membrane de pergament) cu efecte toxice la distanţă (miocardită, polineurită, nefroză).
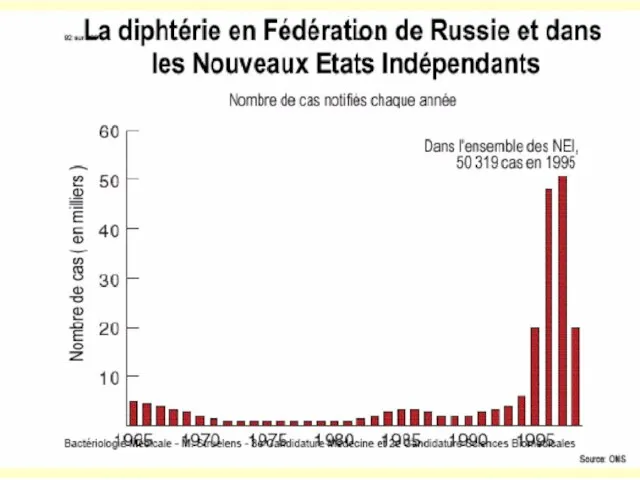
2018 – 16000 cazuri raportate
2015 – 4500 cazuri raportate, 2100 decese
2014 – 7321 cazuri raportate
1991 – 2000 cazuri in fosta URSS
1998 – 200.000 cazuri, 5000 letale (Moldova – apr. 1000 cazuri, peste 200 decese)
Слайд 61821 – Bretonneau individualizează difteria şi demonstrează caracterul ei contagios
1883 -

Klebs descrie bacteria în membranele false de angine difterice
1884 - Loeffler izolează bacteria, apoi demonstrează patogenitatea ei pe cobai
1888 - Roux şi Yersin demonstrează secreţia exotoxinei şi inoculând-o la animal reproduc manifestările difteriei
1890 - Behring şi Kitasato imunizează animalele cu toxină modificată
1923 - Ramon prepară anatoxina difterică, primul vaccin antidifteric
Слайд 7Difteria este provocată de mi/o din genul Corynebacterium, familia Corynebacteriaceae (din greaca

κορωνη corönë (nod, innodat) si βακτηριον bacterion (bastonas)
Genul Corynebacterium reuneşte mi/o care se caracterizează prin prezenţa în compoziţia peretelui celular a:
- acidului mezo-diaminopimelic
- acizilor micolici cu catenă scurtă (22-38 atomi de C)
Prezintă asemănări cu mi/o din genurile Mycobacterium şi Nocardia
Слайд 8Clasificarea genului Corynebacterium
Corinebacterii fitopatogene
Corinebacterii patogene pentru animale, care afectează accidental omul: C.pseudotuberculosis,

C.ulcerans
Corinebacterii cu tropism uman:
Specie patogenă: C.diphtheriae (biovaruri gravis, mitis, intermedius). Colonizează frecvent rinofaringele, mai rar tegumentul. Există şi purtători sănătoşi.
Specii comensale (specii pseudodifterice, difteroizi): C.xerosis, C.jeikeium, C.pseudodiphthericum, etc. Habitat – faringe, rinofaringe, uretra distală, tegument
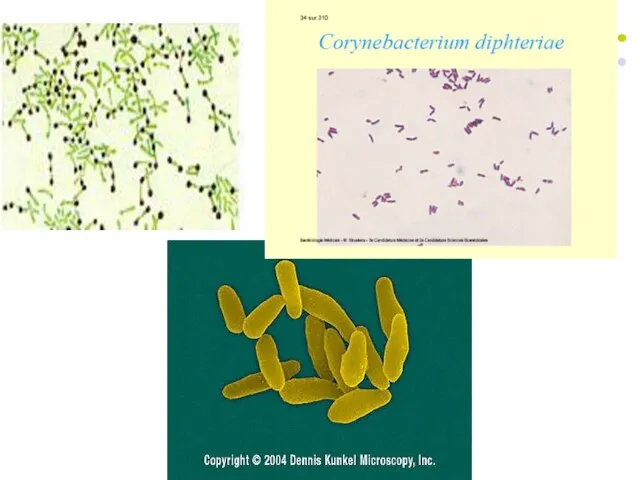
Слайд 9Caractere morfotinctoriale ale C.diphtheriae
Bacterii (bastonaşe) de 1-8 µm x 0,3-0,8 µm, drepte

sau puţin încurbate, cu extremităţile rotunjite sau îngroşate (aspect de halteră sau de măciucă), datorită granulaţiilor de volutină (corpii Babeş-Ernst). În frotiuri se aranjează unghiular, sub forma caracterelor chinezeşti, cifre romane sau litere majuscule: Y, M, N, V... Imobile, asporogene, necapsulate.
Se colorează G+, pentru evidenţierea granulaţiilor de volutină - Loeffler, Albert, Neisser
Слайд 11Caractere de cultură
C.diphtheriae este o specie facultativ anaerobă, exigentă la cultivare,

temperatura optimă de cultivare 37°C, pH 7,4.
Medii de cultură elective:
Mediul Loeffler (ser bovin coagulat): colonii S, mici, netede, opace, albe-cenuşii, apar peste 16-24 ore de cultivare
Geloză-sânge (identic)
Слайд 12Medii de cultură selective diferenţiale
Mediul Clauberg (geloză-sânge cu telurit de potasiu). C.diphtheriae

gravis: colonii R, mari, negre (reducerea teluritului în teluriu), crenelate, aspect de “floare de margaretă”, nehemolitice; mitis: colonii S, mijlocii, negre, bombate, cu zonă de hemoliză
Mediul Tinsdale (geloză-ser-cistină-telurit de potasiu-tiosulfat) - colonii negre cu halou brun
Mediul Bucin (geloză-sânge cu hinozol) – colonii albastre
Слайд 14Medii de transport și îmbogățire
Geloză-ser semisolidă cu telurit de K
Mediul Stuart
Mediul Amies
Mediul

OCST (ou-cistină-ser-telurit)
Activitatea biochimică a C.diphtheriae:
Proteolitică:
Ureaza- (testul Zaks), cistinaza+ (testul Pizu), indol-.
Zaharolitică:
Gravis: glucoza+, amidon+, zaharoza-
Mitis: glucoza+, amidon-, zaharoza-
Posedă catalază, oxidaza-
Se disting 22 lizotipuri de C.diphtheriae şi multiple serogrupuri (antigen O polizaharidic) şi serovaruri (antigen K proteic)
Слайд 15Factori de patogenitate
Toxina difterică - origine proteică, secretată de tulpinile lizogene (fagi

beta, purtători ai genei Tox), în prezenţa unor cantităţi reduse de Fe. Un represor proteic bacterian (DtxR) controlează expresia genei Tox. Acest represor este activat de cantităţi mari de Fe.
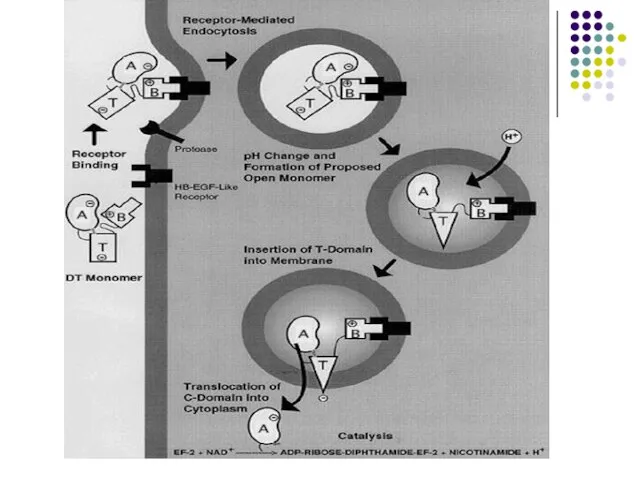
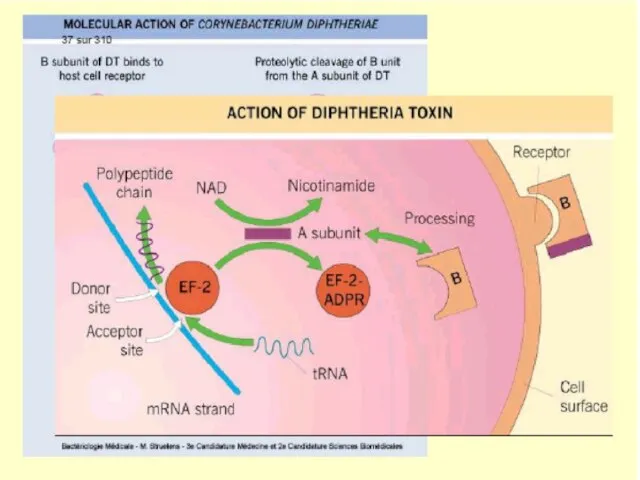
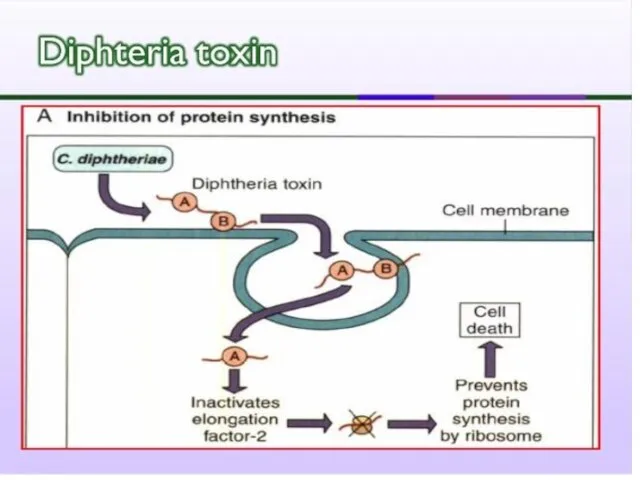
Слайд 16Toxina difterica
Exotoxină tipică (fragmente polipeptidice A şi B). Subunitatea B se leagă

de un receptor de pe celula eucariotă care reglează creșterea și diferențierea celulei. Ulterior ambele fragmente (A și B) pătrund în celulă prin endocitoză. În interiorul endosomei are loc descompunerea toxinei în fragmente individuale. Fragmentul A este translocat în citoplasmă prin porii din membrana endosomei creați de fragmentul B.
Слайд 18Mecanismul de acţiune al toxinei difterice
Toxina hidrolizează NAD şi transferă fragmentul ADP-riboză

format pe factorul de elongare EF-2 (ADP-ribozilare), care nu mai asigură translocarea peptidil-ARNt de la situsul acceptor la situsul donor al ribosomului eucariot. Rezultă stoparea ireversibilă a sintezei proteice.
O singură moleculă este letală pentru celulă !!!
Слайд 21Toxina acționează la poarta de intrare și difuzează în organism perturbând funcţionarea

diferitor organe (în special SNC, cord, rinichi, suprarenale), cauzând distrofii.
Poate fi transformată în anatoxină, utilizată în vaccinare.
Enzime de patogenitate: hialuronidaza, neuraminidaza
Cord factor – un glicolipid toxic din peretele celular
Слайд 22Patogeneza şi formele clinice de difterie
Sursa de infecţie: bolnavul cu difterie

şi purtătorii sănătoşi de germeni (colonizează rinofaringele, rareori tegumentul sau conjunctiva).
Mecanismele şi căile de transmitere:
Direct pe cale aerogenă (picături) sau contact cu plăgi contaminate
Indirect (foarte rar) prin obiecte (jucării,
cărţi), praf sau alimente contaminate
(lactate)
Perioada de incubație – 2-4 zile.
Слайд 23La poarta de intrare bacteriile se multiplică şi provoacă un focar inflamator

local, determinat de acţiunea toxinei, care fiind ulterior difuzată prin limfă şi sânge provoacă starea de intoxicaţie generală.
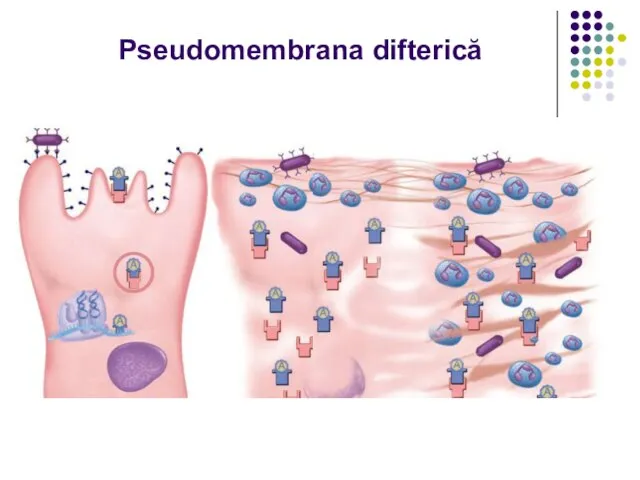
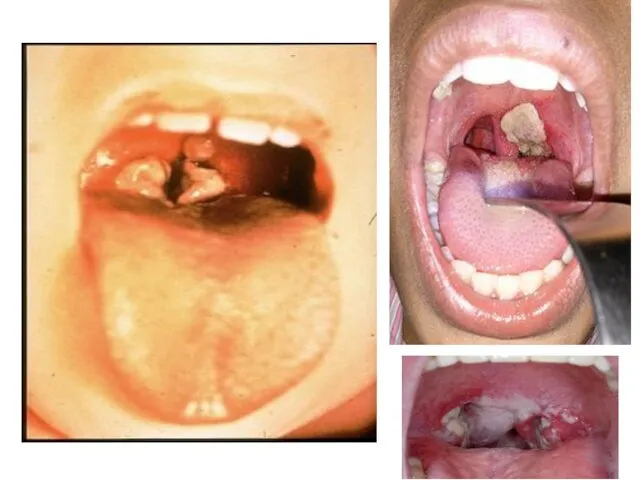
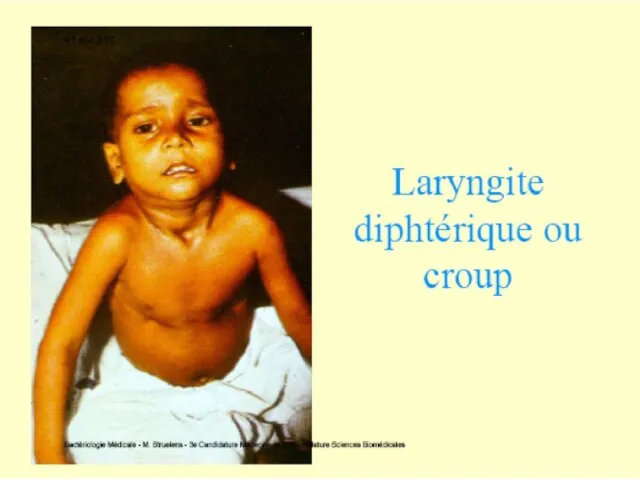
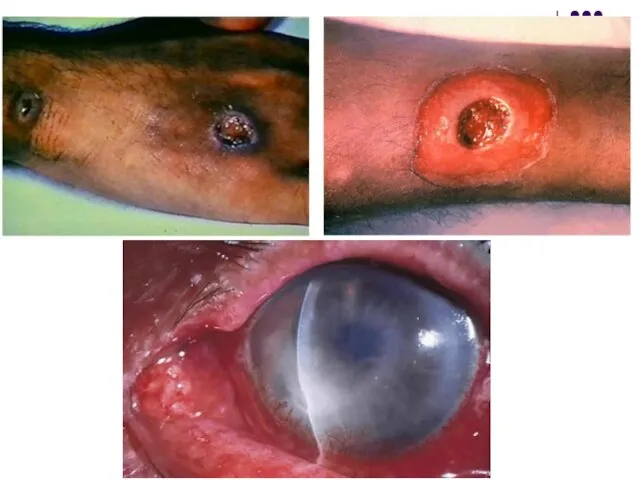
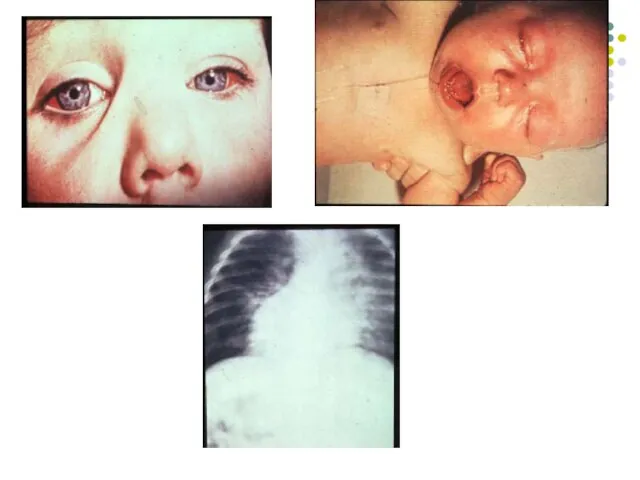
Focarul inflamator se localizează în faringe (faringită, angină difterică), mai rar în laringe (crupul difteric), nas, urechi, conjunctivă, mucoasa organelor genitale, plăgi cutanate.
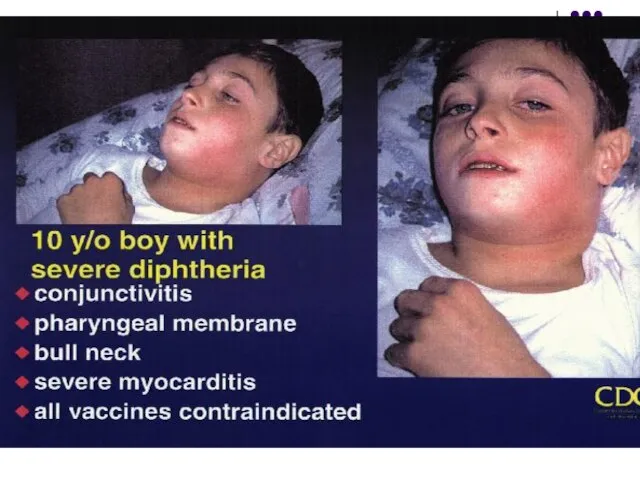
Слайд 24Leziunile locale se caracterizează prin inflamaţie fibrinoasă. Exotoxina cauzează necroză, dilatarea vaselor

şi creşterea permeabilităţii, eliminarea fibrinogenului, care coagulează cu formarea unei pseudomembrane fibrinoase (amigdale, uvulă, palatul moale, faringe). Ea conţine bacterii, hematii, PMN şi celule necrozate. Se detaşează dificil, nu se dizolvă în apă, este reproductibilă in situ în câteva ore. Membrana are tendinţă să se extindă (laringe, trahee) provocând asfixie.
În cazuri necomplicate membrana este eliminată în 5-10 zile.
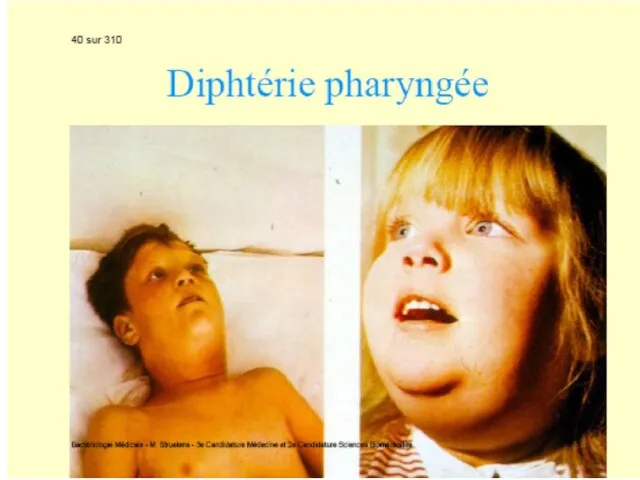
În forma malignă difteria este însoţită de edem al gâtului, semne toxice şi paralizia vălului palatin.
Слайд 31Intoxicaţia generală afectează SNC (disfagie, paralizii), sistemul cardio-vascular (miocardite), suprarenalele (insuficienţă a

suprarenalelor), rinichii (nefroză)
Tulpini de C.ulcerans pot produce toxină identică cu cea difterică.
Diagnosticul de laborator al difteriei
Este URGENT!!!
Prelevate – în funcţie de forma clinică, (membrana falsă, tampoane de la periferia membranelor, tampoane cutanate, conjunctivale, etc), respectând strict regulile de prelevare şi transport.
Слайд 32Metode de diagnostic
Examenul microscopic (Gram, Loeffler, Neisser, Albert), microscopia imunofluorescentă
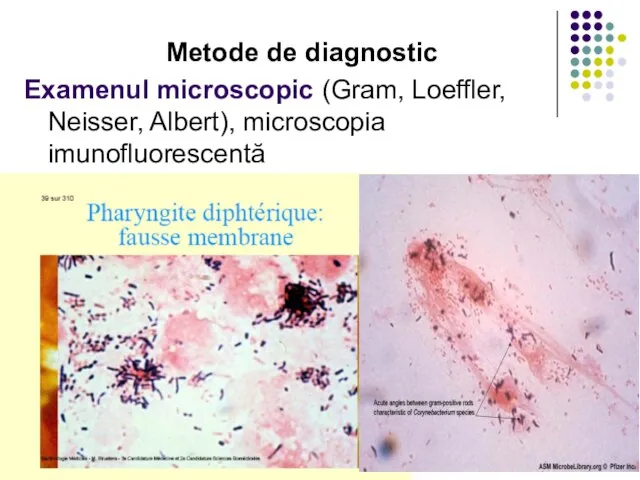
Слайд 33Examenul bacteriologic (izolarea, identificarea culturii pure).
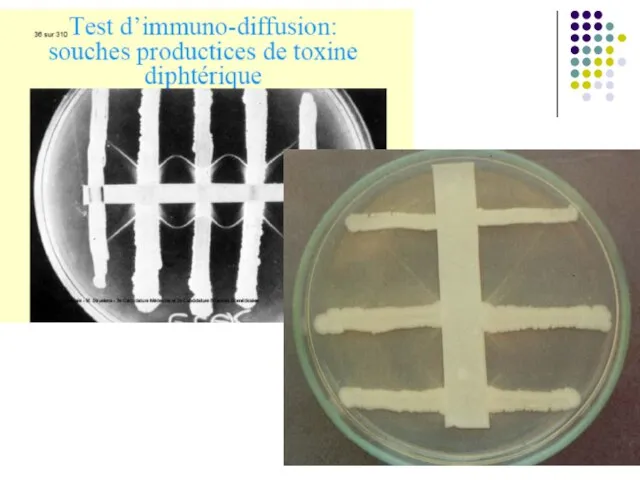
Studierea toxigenezei – obligator. Se efectuează

prin RN cu ser antitoxic in vitro (RP Elek), in vivo (cobai), sau depistarea genei Tox în prelevat sau în cultura pură prin PCR.
Слайд 35Examenul serologic – retrospectiv
RA cu seruri perechi (I săptămână şi a

III) şi cultură de C.diphtheriae. Titrul semnificativ – 1:100 sau creşterea titrului de Ac.
Evaluarea titrului de antitoxine în serul bolnavului (RN, RHAI, RLA, ELISA). La debutul bolii antitoxinele sunt absente sau nu depăşesc nivelul de 0,5 UI/ml
Слайд 36Receptivitatea la difterie poate fi determinată prin:
Testul Schick (in vivo): i/dermic 0,1

ml toxină difterică (1/40 DLM) – 48h
Reacţie+: eritem 1cm (receptivitate la difterie),
reacţie-: lipsa eritemului (persoană imună)
RN in vitro / RP
RHAI
ELISA
Titrul antitoxinelor > 0,03 UA/ml – protector
Titru inferior 0,01 UA/ml – lipsa protecţiei
Слайд 37Tratamentul difteriei
Seroterapie precoce (ser antitoxic antidifteric, Ig). Neutralizează activitatea toxinei, blocând fixarea

ei pe receptorii celulari.
Antibioterapie (macrolide, tetracicline, cloramfenicol, aminozide, beta-lactamine). Asigură eradicarea germenilor.
Tratament simptomatic
Слайд 38Profilaxia specifică a difteriei
Vaccinarea obligatorie cu anatoxină difterică a copiilor conform calendarului

de vaccinări. Există vaccinuri asociate: DT, DTP, HepB+DTP+Hib.
Vaccinarea primară cu DTP la 2-4-6 luni; revaccinarea la 22-24 luni cu DTP; la 6-7 cu DT, la 15-16 ani cu Td, revaccinarea adultilor cu Td la fiecare 10 ani incepând cu vârsta de 20 de ani.
Quinvaxem – pentavaccin (DTP-HepB-Hib)
Recent a fost obţinut un vaccin sintetic antidifteric. Reprezintă un polipeptid antigenic situat la joncţiunea fragmentelor A şi B a toxinei difterice, o moleculă peptidică “purtătoare” şi un adjuvant sintetic.
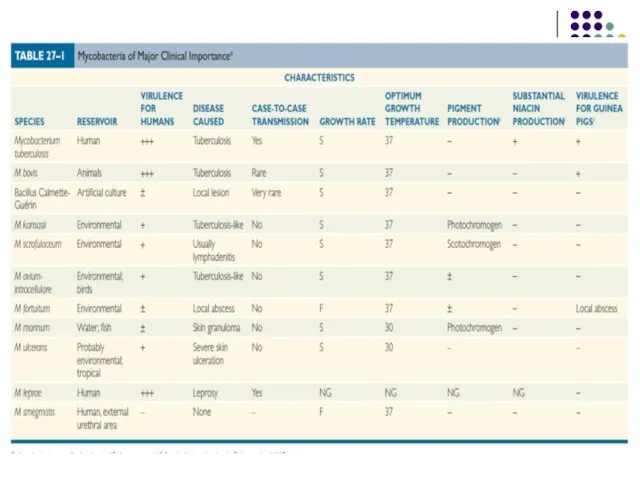
Слайд 39MICOBACTERIILE. MICROBIOLOGIA ŞI DIAGNOSTICUL DE LABORATOR AL TUBERCULOZEI
Familia Mycobacteriaceae
Genul Mycobacterium
Specii:
Responsabile de tuberculoza

umană: M.tuberculosis, M.bovis, M.africanum, M.canetti (“tuberculosis complex”) - cultivabile
Agentul leprei: M.leprae (strict umană, necultivabila)
Micobacterii “atipice”, condiţionat patogene: M.avium-intracellulare, M.ulcerans, M.fortuitum, M.kansasii, M.marinum, etc. Cauzează micobacterioze la persoane imunocompromise
Micobacterii nepatogene: M.smegmatis, M.gastri, M.phlei
Слайд 41Caracteristica generală a micobacteriilor:
Bastonaşe G+ drepte sau uşor încurbate, necapsulate, asporogene,
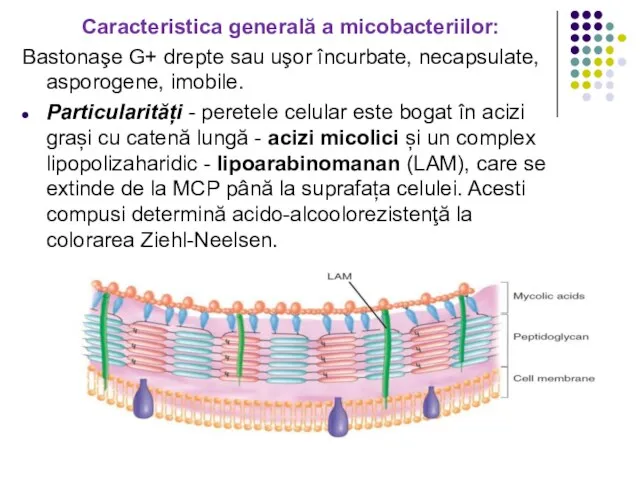
imobile.
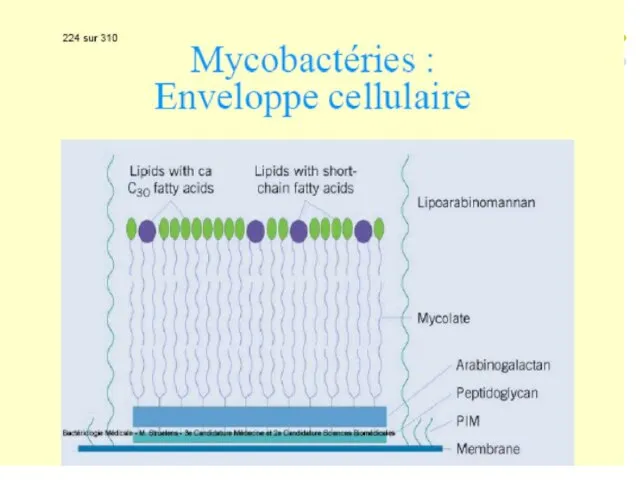
Particularități - peretele celular este bogat în acizi grași cu catenă lungă - acizi micolici și un complex lipopolizaharidic - lipoarabinomanan (LAM), care se extinde de la MCP până la suprafața celulei. Acesti compusi determină acido-alcoolorezistenţă la colorarea Ziehl-Neelsen.
Слайд 43Caracterele morfobiologice ale M.tuberculosis
M.tuberculosis este o bacterie patogenă strict umană, responsabilă de

tuberculoză. Este sensibilă la căldură, lumină solară directă, raze UV sau X. Rezistentă la frig sau desicare. Este puţin sensibilă la acizi, baze (se utilizează în decontaminarea prelevatelor) sau detergenţi şi foarte sensibilă la soluţia de alcool de 70°.
Tulpina M.tuberculosis genotipurile Beijing și Ural – foarte virulente, rezistente la preparate antituberculoase
Слайд 44Mycobacterium tuberculosis a fost cauza "Pestei Albe" în sec. 17 şi 18

în Europa.
În această perioadă aproape 100% din populaţia Europei a fost infectată cu M.tuberculosis şi 25 % din adulţi au decedat.
R. Koch descopera agentul tuberculozei la 24 martie 1882 (1905 - premiul Nobel în medicină)
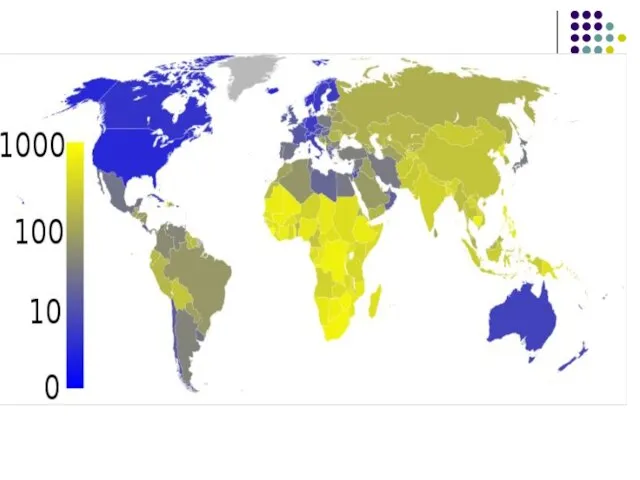
Tuberculoza (TB) în prezent este prima cauză de deces din lume dintre toate infecţiile bacteriene (3 mln /an). Aproximativ 1/3 din populatie este infectata, anual apar peste 9 mln cazuri noi de tuberculoza.
Слайд 45RM incidenţa TB:
1990 – 49 cazuri la 100.000 (2149);
2006 – 132

cazuri (5461 anual),
2013 – 106,4 (3788),
2014 – 95,6 (3399),
2015 – 83,9 (2981)
2016 – 70,2 (2829)
2017 – 66,2 (2663)
2018 – 86 (3500)
Слайд 46În 2020 în Republica Moldova au fost înregistrate
1761 de cazuri de

îmbolnăvire cu tuberculoză.
În 2020, numărul total al bolnavilor de tuberculoză
a fost de 2337 de persoane.
Rata îmbolnăvirilor cu tuberculoză în Republica Moldova raportată la 100 de mii de locuitori constituie 43.9 persoane.
În 2020 din cauza tuberculozei au decedat 208 locuitori ai Republicii Moldova.
Raioanele cu cea mai înaltă rată a îmbolnăvirilor cu tuberculoză sunt Rîbnița, Dnestrovsk, Slobozia, Șoldănești, Rezina, Nisporeni, Leova.
În 2020, au fost înregistrați 441 de bolnavi cu TB MDR.
Prevalenţa TB MDR printre cazurile noi de tuberculoză înregistrate în 2020 (9 luni) este de 24,9 %.
Слайд 48Caractere morfotinctoriale
M.tbc este un bastonaş fin sau uşor încurbat, în frotiu se
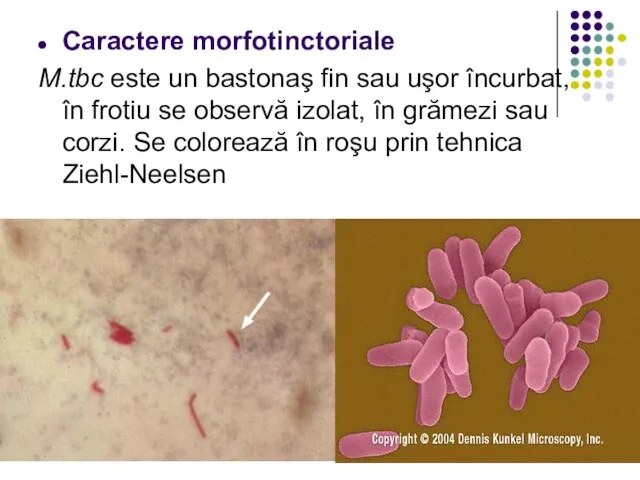
observă izolat, în grămezi sau corzi. Se colorează în roşu prin tehnica Ziehl-Neelsen
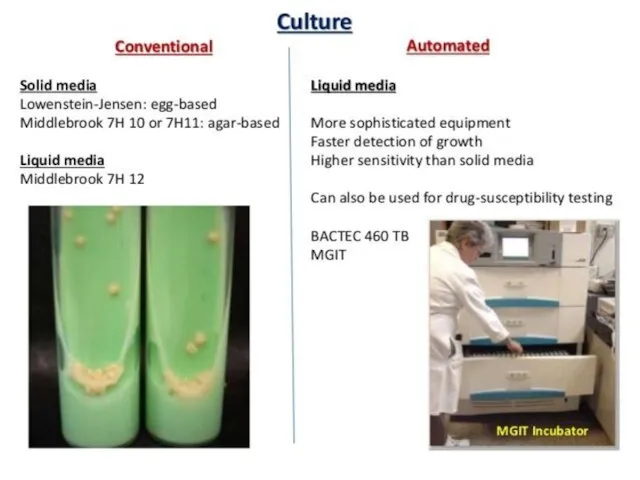
Слайд 49Caractere de cultură
M. tuberculosis este o bacterie strict aerobă, foarte exigentă la

cultivare. Toate mediile de izolare au la bază ou coagulat. Mediul de referinţă – Lowenstein-Jensen (ou, glicerină, asparagină, verde de briliant).
Alte medii solide – Popescu (acid glutamic în locul asparaginei), Finn (glutamat de Na).
Слайд 50Micobacteriile patogene cresc lent (perioada de generaţie – 20 ore), la 37°C,

pH 6,8-7,0.
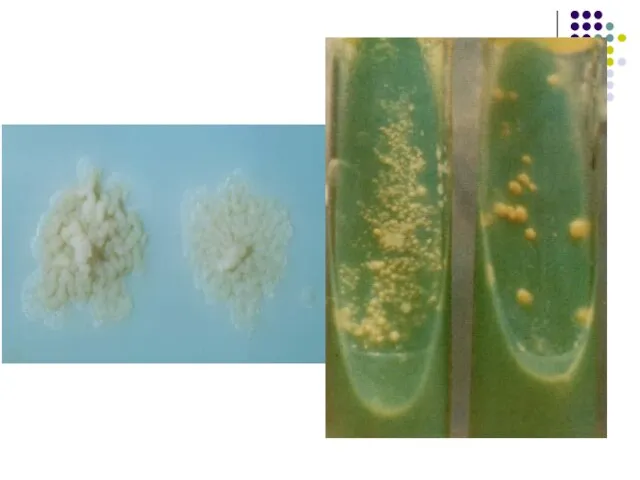
Coloniile de M.tuberculosis apar peste 2-4 săptămâni, sunt rugoase, friabile, conopidiforme, opace, de culoare crem-bej (colonii R).
M.bovis şi M.africanum formează colonii S, mici, netede, nepigmentate, vizibile peste 4-8 săptămâni.
Слайд 52Medii de cultură lichide (mediul 7H9, Middlebrook 7H12, Sauton, etc).
Mediul Sauton conţine

săruri minerale, asparagină, glicerină. M.tuberculosis creşte în 8-10 zile sub formă de voal. Este utilizat şi pentru repicarea tulpinilor de BCG.
Activitatea biochimică a micobacteriilor patogene
Toate micobacteriile patogene produc o catalază termolabilă, distrusă la 68°C timp de 20 min. Celelalte micobacterii posedă catalază termostabilă.
M.tuberculosis şi M.bovis hidrolizează ureea
M.tuberculosis produce acid nicotinic (niacină), reduce nitraţii în nitriţi. M.bovis nu manifestă astfel de activitate.
Слайд 53Factorii de patogenitate ai micobacteriilor
Acizii micolici. Previn distrugerea micobacteriilor în macrofage, protejează micobacteriile

extracelulare de complementul din ser. Condiţionează transformarea macrofagelor în celule epitelioide şi celule gigante Langhans.
Lipoarabinomananul – efecte similare LPZ din bacteriile gramnegative
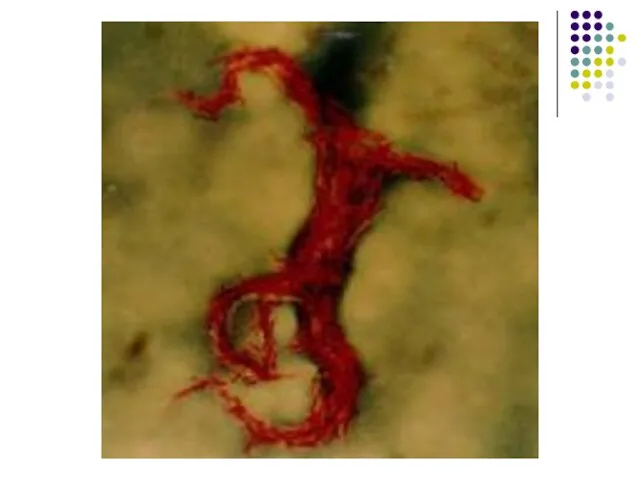
Cord-factorul (trehalose dimycolate) perturbă respiraţia în mitocondrii şi inhibă migraţia PMN. Induce cultivarea în corzi (cosiţe) a M.tuberculosis.
Ceara – stimuleaza raspunsul imun celular, hipersensibilitatea tardiva
Proteina ESAT-6 (early secreted antigenic target) – facilitează legarea bacteriilor de laminina din membrana bazală a celulelor epiteliale alveolare, cauzează citoliză
1-tuberculosinyladenosine (1-TbAd) – nucleozid particular cu rol de antacid. Secretat de M.tbc, acopera bacteria si neutralizeaza pH din fagocite
Слайд 56Lipidele din peretele celular al Mycobacterium tuberculosis sunt asociate cu următoarele proprietăţi

ale bacteriei:
• Impermeabilitate la colorare
• Rezistenţă la multe antibiotice
• Rezistenţă la substanţe acide şi alcaline
• Rezistenţă la activitatea litică a complementului
• Rezistenţă la oxidare şi supravieţuire în interiorul macrofagelor
Polizaharidele joacă un rol important în formarea Ac serici, conferind specificitatea imunologică.
Proteinele reprezintă suportul imunităţii celulare şi al hipersensibilităţii tardive.
Слайд 57Patogeneza şi formele clinice
de tuberculoză
Sursa de infecţie – omul bolnav cu

TB pulmonară bacilară (M.tuberculosis, M.africanum) sau bovinele bolnave (M.bovis). Un bolnav cu tuberculoză activă infectează 10-15 persoane anual.
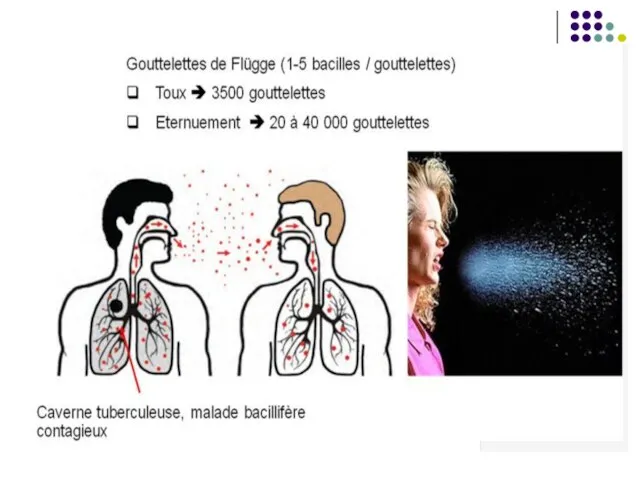
Transmiterea se efectuează pe cale aeriană (picături, praf). Inhalarea a cel mult 10 bacterii poate determina infecţia. Rareori este posibilă contaminarea prin obiecte, alimente (lapte nepasteurizat) sau mâini contaminate.
Receptivitatea este influenţată de vârstă şi factorii de mediu: carenţe nutritive, alcoolism, stare imunosupresivă, etc
Слайд 59Primoinfecţia tuberculoasă și
tuberculoza latentă
Reprezintă un ansamblu de manifestări clinice, umorale şi

anatomice care se desfăşoară în organism în urma primului contact cu agentul TB.
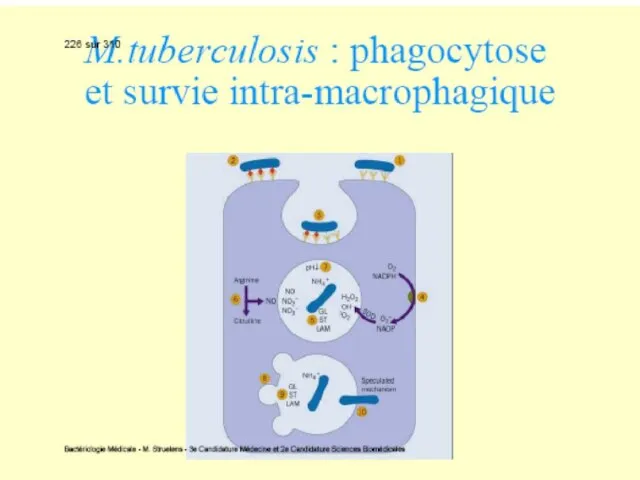
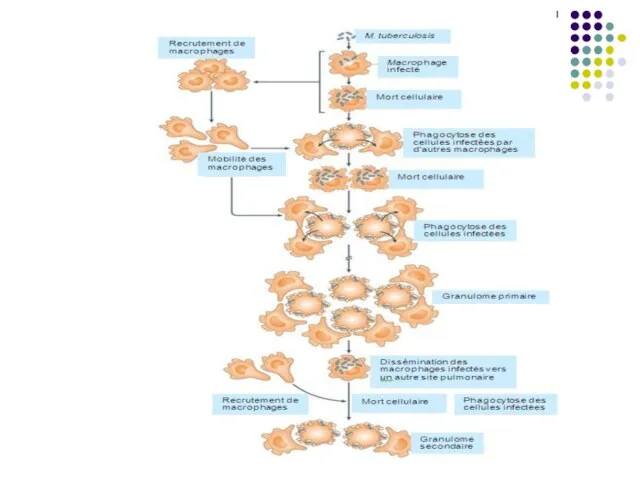
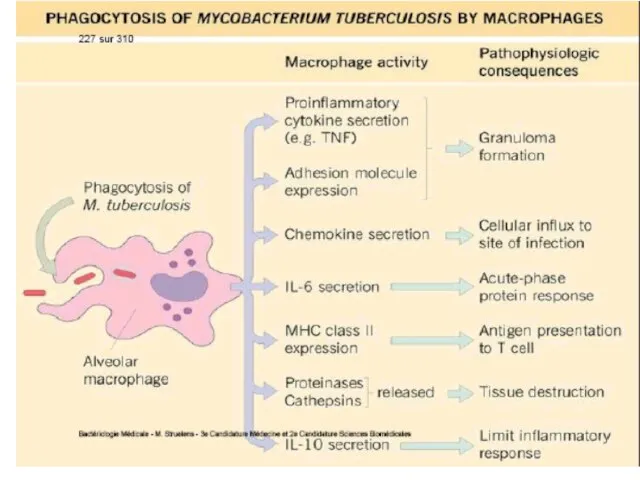
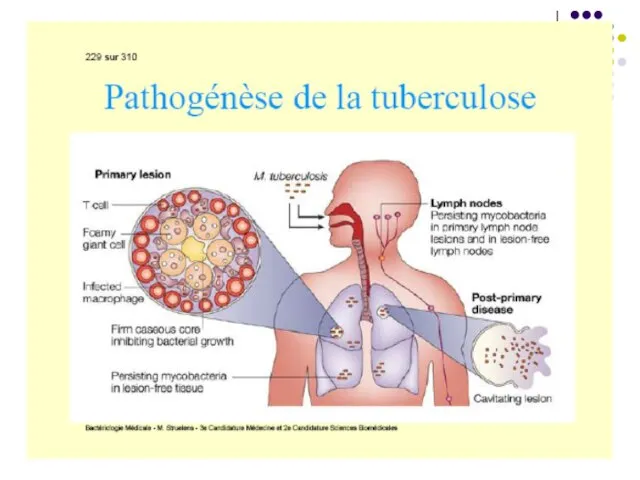
După contaminare (mai frecvent în copilărie), bacteriile pătrund în alveolele pulmonare (90%), unde sunt captate de celulele dendritice și macrofage în care se multiplică (bacterii facultativ intracelulare). Urmează moartea acestor celule cu fagocitarea lor de alte macrofage recrutate. Procesul se repetă determinând formarea unei leziuni inflamatoare nespecifice.
Слайд 62Agentul tuberculozei determină întârzierea dezvoltării imunității dobândite celulare.
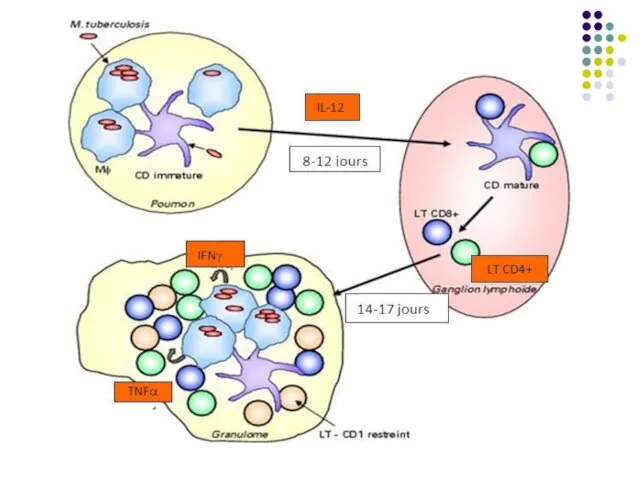
Prin intermediul celulelor dendritice M.tbc

ajunge în ganglionii limfatici regionali, unde are loc activarea și diferențierea LT naive în celule efectoare, care migrează în plămâni, la nivelul leziunii pulmonare inițiale, contribuind la formarea granulomului.
Слайд 65Astfel, peste câteva săptămâni (4-12) se dezvoltă imunitatea celulară şi leziunea primară

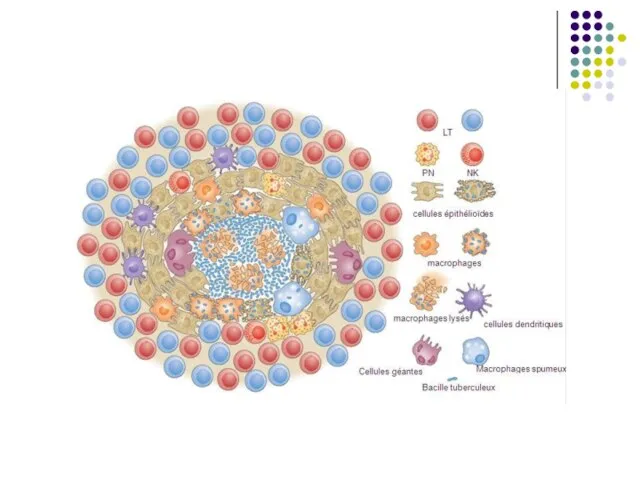
evoluează în leziune granulomatoasă. Sub acţiunea unor citokine secretate de limfocitele T (în special IFN gamma, TNF) are loc activarea macrofagelor, care devin deja capabile sa distrugă micobacteriile. În acelaşi timp macrofagele activate se diferenţiază în celule epitelioide şi celule multinucleate gigante Langhans. Sunt prezente și neutrofile, celule dendritice, NK. Ele sunt înconjurate de limfocite şi fibroblaste. Acesta este granulomul tuberculos, semn caracteristic primo-infecţiei. Infecţia se extinde pe cale limfatică, cu afectarea ganglionilor regionali.
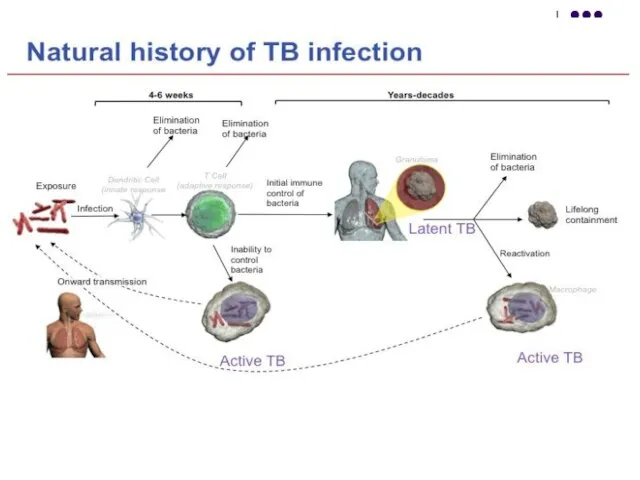
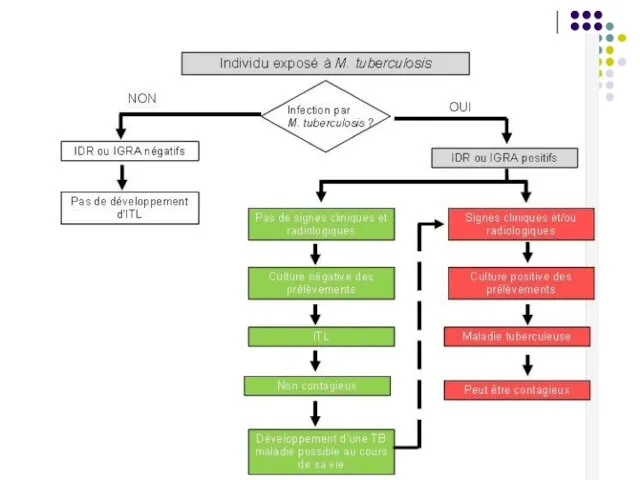
Слайд 67- Primoinfecţia inaparentă. La cca 85-90% leziunile se vindecă cu persistența bacteriilor

inactive sau cu autosterilizare. Nicio expresie clinică sau radiologică.
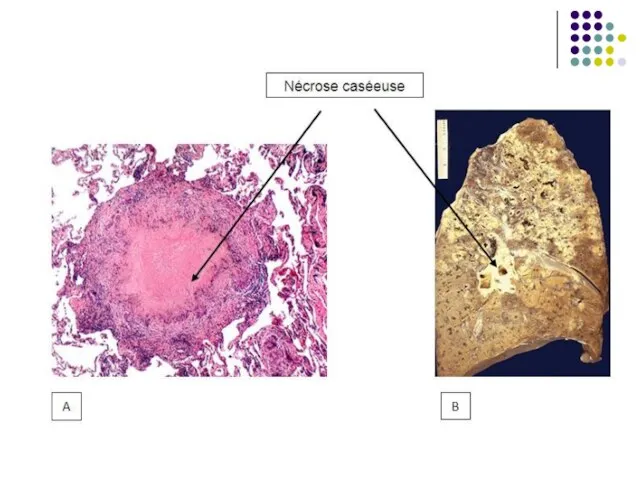
Dacă multiplicarea bacteriilor este masivă, în leziunile tuberculoase se realizează o necroză cazeoasă (tuberculom).
Frecvent are loc calcifierea tuberculomului (leziunea este vizibilă radiologic), cu autosterilizarea spontană sau cu persistenţa unor bacterii în leziune. Bacteriile rămân inactive, dar viabile timp de mulţi ani. Această stare este cunoscută ca infecţie tuberculoasă latentă (90% din cazuri).
Consecinţele primoinfecţiei inaparente sau latente: dezvoltarea imunităţii antituberculoase şi a sensibilizării tuberculinice.
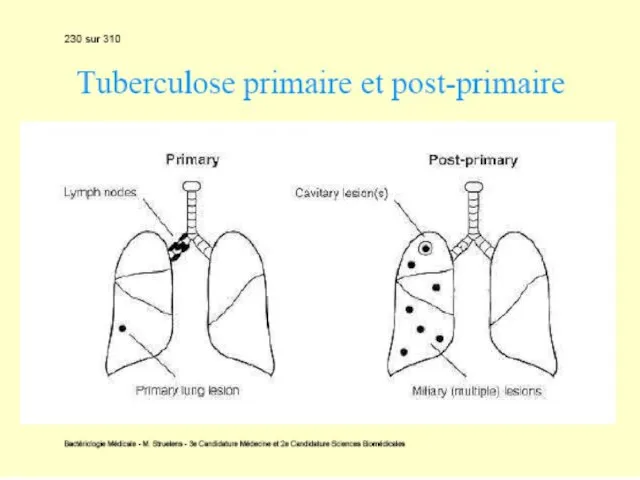
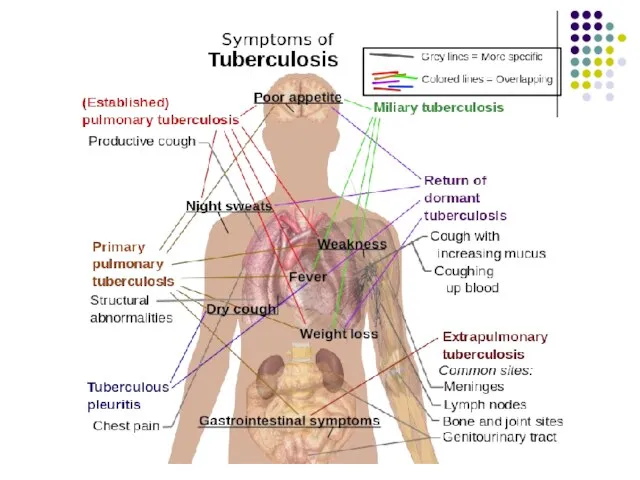
Слайд 69Tuberculoza primară manifestă necomplicată. Pacienţii au febră, tuse, astenie, pierdere în greutate,

transpiratii nocturne, etc. Etapa ganglionară poate fi depăşită cu diseminări hematogene şi afectarea pleurei, meningelui, măduvei osoase, parenhimei organelor. Leziunile pot evolua fie spre spre cicatrizare, fie spre agravare.
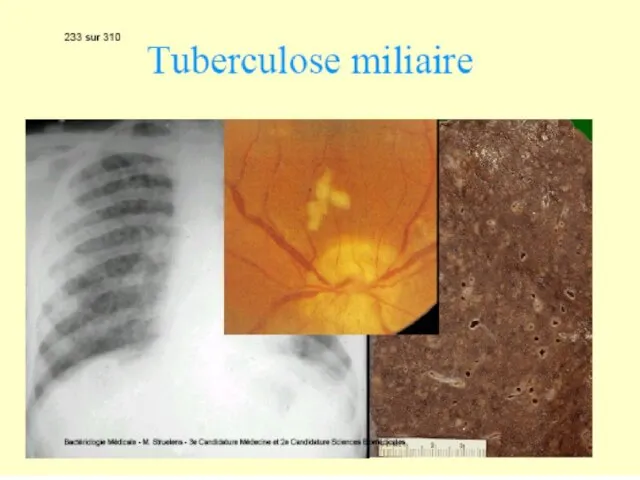
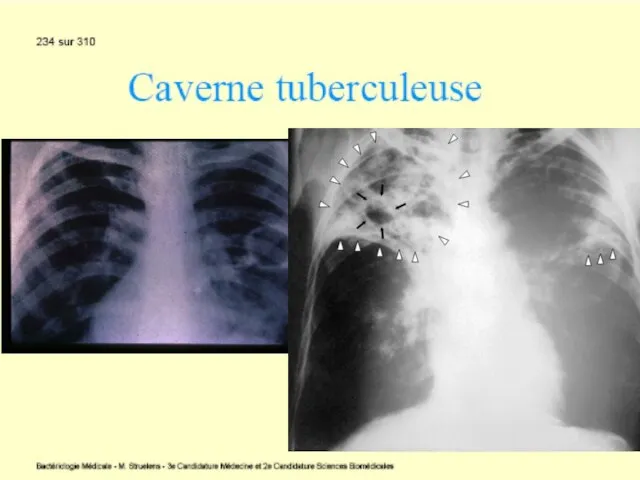
Tuberculoza primară cu complicaţii. Rareori (10% cazuri), evoluţia este defavorabilă: masele necrotice sunt evacuate în bronşii, vase sanguine, pleură sau pericard cu formarea unei caverne, unde bacteriile se multiplică intens. Fistulizarea într-un vas sangvin diseminează infecţia sistemic (tuberculoza miliară). Starea generală este alterată, cu febră, tuse, uneori hemoptizie. Bolnavul este contagios, eliminând bacterii cu sputa.
Слайд 76Tuberculoza secundară. Se manifestă în condiţii de scădere a reactivităţii imune, prin

reinfecţii masive sau reactivarea unor focare latente. Focarele noi apar în ritm lent şi evoluează cronic fără tendinţă de vindecare spontană.
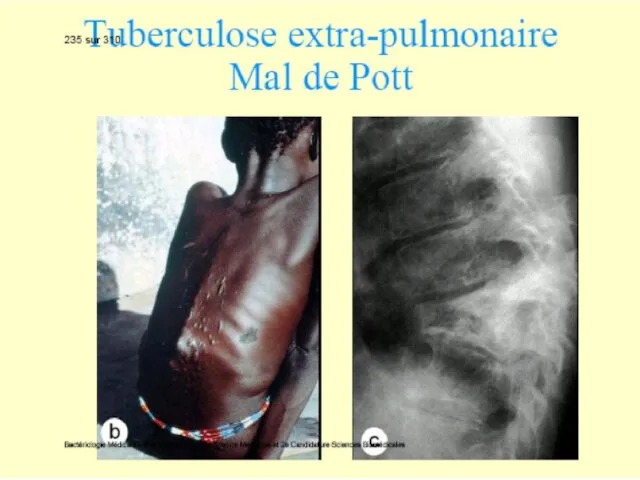
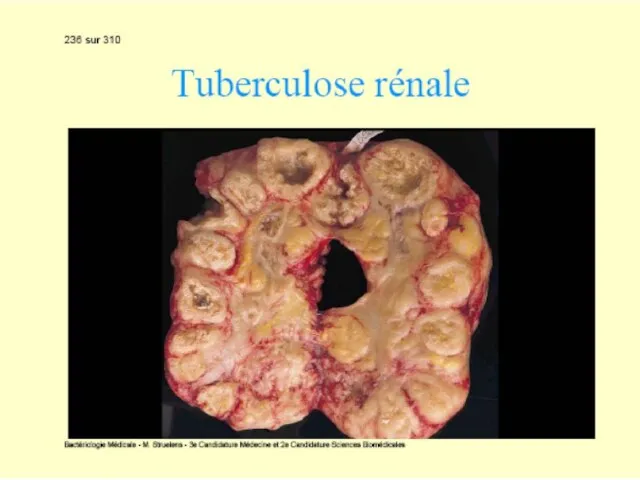
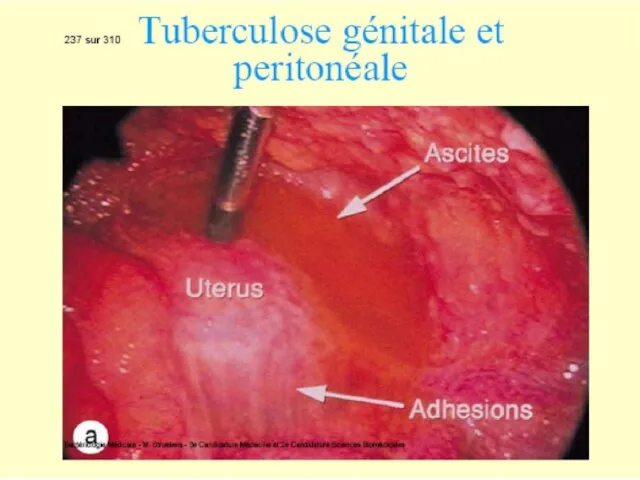
Alte forme clinice de tuberculoză: ganglionară, meningeană, osteo-articulară, uro-genitală.
Imunitatea antituberculoasă este celulară, nesterilă. Hipersensibilitatea tardivă însoţeşte imunitatea celulară. Ac circulanţi nu au rol protector.
Слайд 81Diagnosticul de laborator al tuberculozei
Prelevate: în funcţie de forma clinică: sputa matinală

(5-10 ml), tubaje gastrice, urină, lichid pleural, articular, peritoneal, LCR, bioptate, etc
În caz de necesitate se efectuează omogenizarea /decontaminarea cu NaOH şi concentrarea (prin centrifugare) a prelevatelor.
Metode de diagnostic
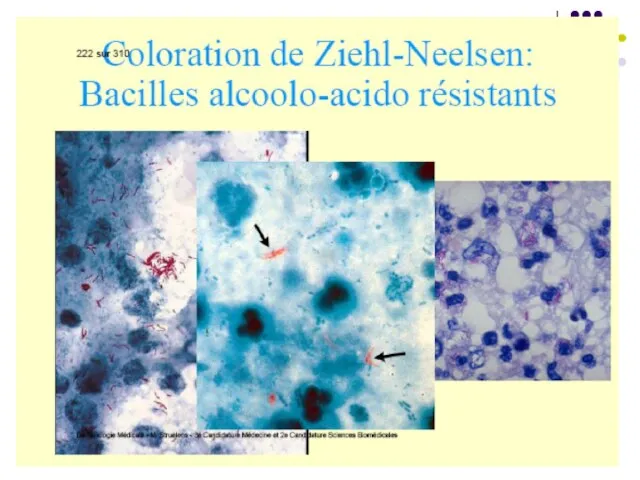
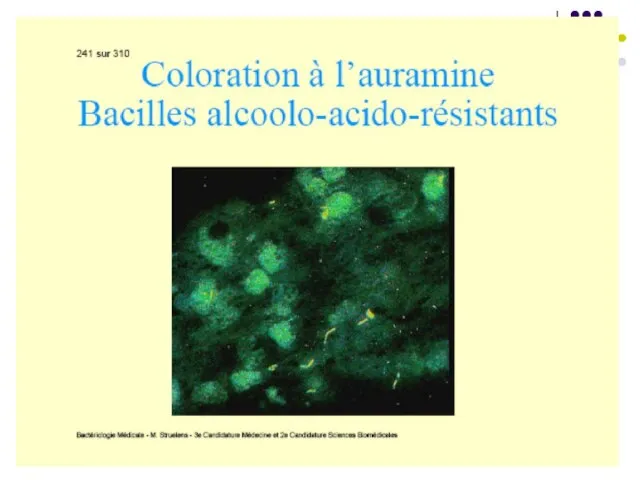
1. Examenul microscopic – frotiuri colorate Ziehl-Neelsen (bastonaşe purpurii izolate) sau cu fluorocromi (auramină sau amestec auramină+rodamină) - bastonaşe galbene pe fond negru. Sensibilitatea – 104 bacili/ml
Слайд 842. Examenul bacteriologic clasic– izolarea culturii pure pe mediile speciale, identificarea ei,

testarea sensibilităţii la chimioterapice (prin metoda diluţiilor în mediu solid – metoda concentraţiilor absolute). Rezultat peste 2-2,5 luni
Examenul bacteriologic rapid (sistemul BACTEC, metoda MB/BacT). Rezultat pozitiv în 3-21 zile
Sunt utilizate medii lichide. Principiul metodei – se apreciază scăderea concentraţiei oxigenului din mediu odată cu multiplicarea micobacteriilor. Lectura este automată.
3. Metoda biologică (inocularea la cobai). Serveşte uneori pentru confirmarea virulenţei micobacteriei
4. PCR pentru detectarea rapidă al ADN micobacteriilor direct în prelevate. Permite detectarea genelor de rezistenţă la preparate antituberculoase
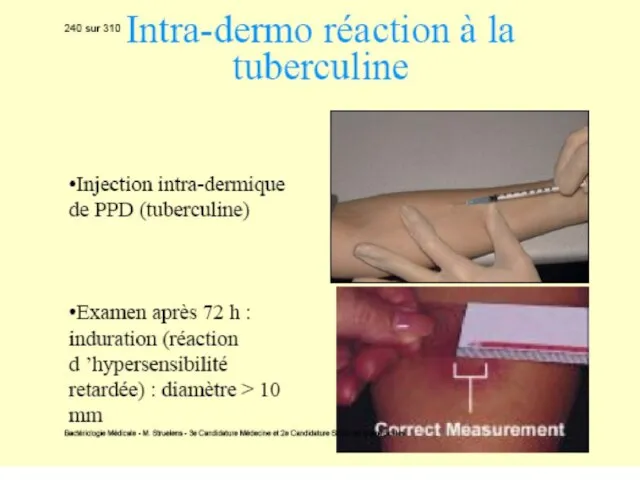
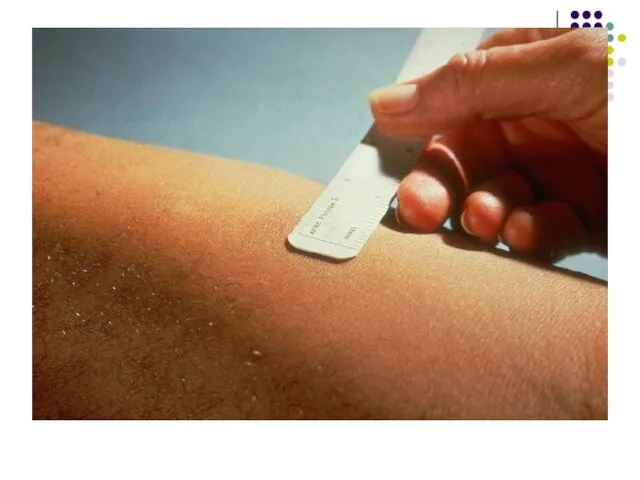
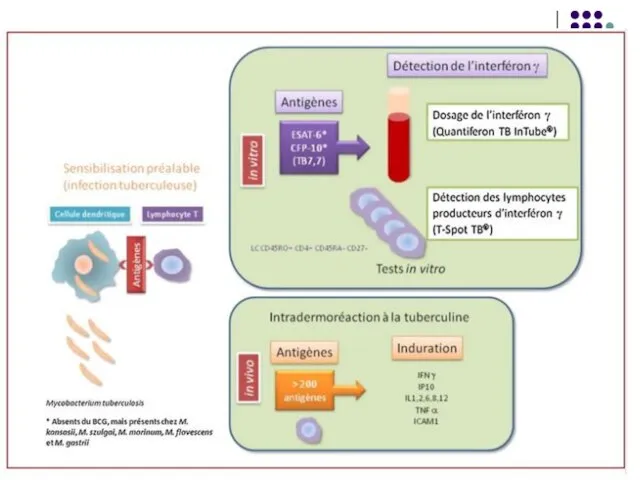
Слайд 865. Intradermoreacţia la tuberculină (reacţia Mantoux). Se cercetează starea de hipersensibilitate cutanată

la tuberculină. Tuberculina reprezintă un filtrat proteic dintr-o cultură bulionică autoclavată de M.tuberculosis.
Pe faţa anterioară a antebraţului se injectează i/dermic 2; 5 sau 10 UI de tuberculină în volum de 0,1 ml. Lectura peste 72 ore. Reacţia pozitivă se manifestă printr-o induraţie şi congestie cu diametrul superior sau egal cu 5 mm. Interpretarea se efectuează în funcţie de contextul clinic
Reacţia + indică că subiectul a fost infectat cu micobacterii (primoinfecţie), a fost vaccinat cu BCG sau este bolnav de tuberculoză (în acest caz diametrul depăşeşte 10 mm).
Reacţia negativă exclude diagnosticul de tuberculoză şi indică receptivitatea individului la tuberculoză.
Слайд 89Interferon-γ (interferon-gamma) release assays (IGRAs).
Se bazeaza pe capacitatea unor antigene ale

M. tuberculosis de a stimula producerea IFN-γ de catre gazda. Aceste Ag lipsesc la alte micobacterii sau la tulpina vaccinanta BCG, astfel poate fi depistata infectia tuberculoasa latenta.
Un test ELISA este utilizat pentru cuantificarea interferonului.
Слайд 92În Moldova activează 59 de laboratoare de microscopie a sputei pentru depistarea

Mycobacterium tuberculosis.
În afară de aceasta, în Chişinău, Bălţi, Bender şi Vorniceni funcționează şi Laboratoare de Referință în microbiologia tuberculozei unde se efectuează examene microbiologice pentru depistarea rezistenței la preparatele medicamentoase.
Слайд 93Tratamentul tuberculozei
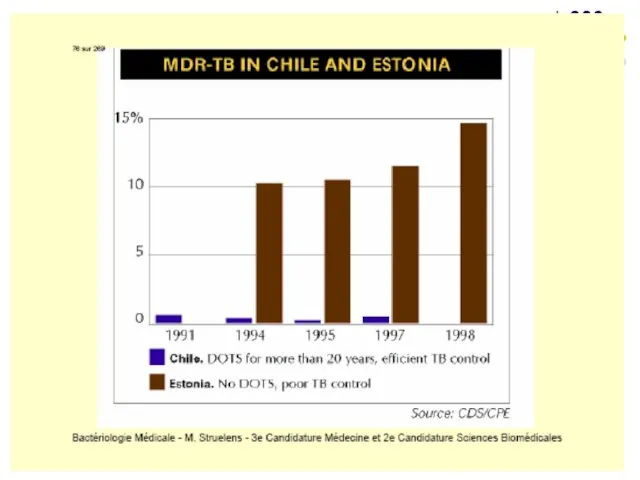
DOTS (Directly Observed Treatment Short Course Chemotherapie). DOTS este o strategie

a OMS implementată în 1993
Principiile DOTS
- tratament standardizat
- tratament bifazic constituit dintr-o fază intensivă şi faza de continuare
- asocieri de medicamente antituberculoase
- supraveghere directă a regularităţii administrării tratamentului antituberculos
Din 2005 – Program Naţional de Control şi Profilaxie a Tuberculozei
Слайд 95Chimioterapice care inhibă sinteza acizilor micolici (Izoniazida, Pirazinamida, Etambutolul, Etionamida) – de

prima linie
Antibiotice cu spectru larg: rifampicină, streptomicină, kanamicină, D-cicloserină
Fluorochinolone – linia a doua
Antibiotice noi - Bedaquiline, Delamanid
Exigenţele terapiei antituberculoase: a împiedica selecţia mutanţilor rezistenţi şi a steriliza definitiv focarul.
În acest scop se utilizează asocierea a 3-4 preparate pe o perioadă de 6-12 luni.
Слайд 97MDR-TB – tuberculoza multidrogrezistentă (tulpini rezistente la Izoniazidă şi Rifampicină)
XDR-TB – tuberculoza

cu rezistenţă extinsă (tulpini rezistente la chimioterapice de linia a 2)
OMS – 500.000 de cazuri noi de TB MDR pe an
79% din cazurile tuberculozei rezistente sunt cauzate de tulpini XDR.
În RM prevalenţa MDR-TB printre cazurile noi a constituit în 2006 19,4%, 2015 - 26%, 2017 – 28%, 2018 – 29%
Rata de acoperire cu tratament:
2013 – 80,8%, 2014 – 82,6%, 2017 – 83%, 2018 – 87%
Слайд 99Strategia OMS
The WHO End TB Strategy, adopted by the World Health Assembly in

May 2014, is a blueprint for countries to end the TB epidemic by driving down TB deaths, incidence and eliminating catastrophic costs. It outlines global impact targets to reduce TB deaths by 90%, to cut new cases by 80% between 2015 and 2030, and to ensure that no family is burdened with catastrophic costs due to TB.
Ending the TB epidemic by 2030 is among the health targets of the newly adopted Sustainable Development Goals. WHO has gone one step further and set a 2035 target of 95% reduction in deaths and a 90% decline in TB incidence – similar to current levels in low TB incidence countries today.
Слайд 100Profilaxia specifică
Vaccinarea obligatorie cu vaccinul BCG. El reprezintă o tulpină vie avirulentă

de M.bovis. A fost obţinută de Calmette şi Guerin în 1921 după multiple repicări (230 pasaje) pe mediu cu cartof, bilă şi glicerină.
Vaccinul se administrează i/dermic la vârsta de 2-5 zile de la naştere.
Слайд 101MICROBIOLOGIA ŞI DIAGNOSTICUL DE LABORATOR AL TUSEI CONVULSIVE
Familia Halobacteriaceae
Genul Bordetella
Specii:
Bordetella pertussis (agentul

tusei convulsive)
Bordetella parapertussis (agentul parapertusei)
Bordetella bronhiseptica (pneumonii, bacteriemii)
Bordetella avium
Bordetella holmensii (izolată din hemoculturi)
Bordetella hinzii (izolată din prelevate respiratorii)
Bordetella trematum (infecţii cutanate şi auriculare)
Слайд 103B.pertussis – agentul cauzal al tusei convulsive
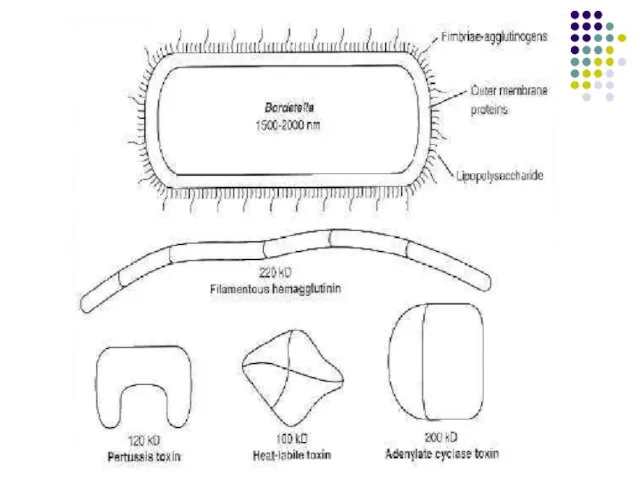
Caractere morfobiologice
Cocobacterii G-, asporogene, imobile, formează

microcapsulă, în frotiu se dispun separat, în perechi sau lanţuri scurte.
Reprezintă mi/o strict aerobe, foarte pretenţioase la cultivare.
Medii speciale de izolare:
- mediul Bordet-Gengou (geloză-sânge cu amidon şi glicerină)
geloză-cazeină-sânge-cărbune activat
Mediul de transport Kuzneţov (soluţie tampon fosfat, 0,5% agar-agar, 0,2% cărbune activat)
Слайд 104Peste 3-5 zile de incubare în atmosferă umedă la 37° C apar

colonii S mici, bombate, lucioase, cu aspect de picături de mercur, hemolitice (corespund bacteriilor virulente – faza I), forme R – avirulente, faza IV.
Coloniile de B.parapertussis apar în 48 ore, B.bronchiseptica – în 24 ore
B.pertussis manifestă activitate biochimică redusă: oxidaza+, nu fermentează glucidele, ureaza-, nitrat-reductaza- .
Слайд 105Structura antigenică a B.pertussis este complexă: există Ag capsulare polizaharidice, Ag proteice,

Ag fimbrial (hemaglutinina), Ag lipopolizaharidic.
Factorii de patogenitate
Adezine:
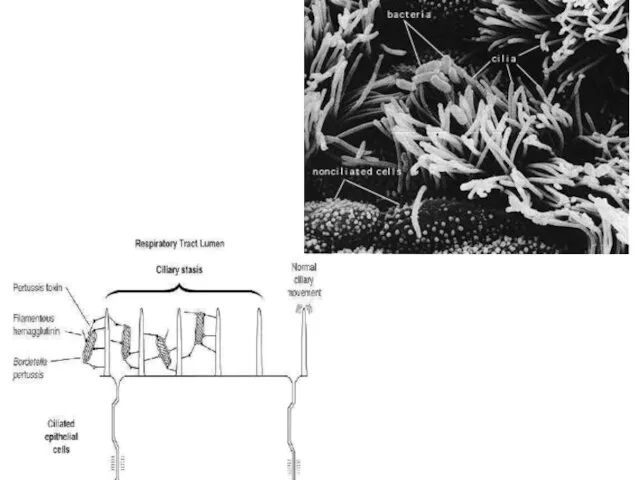
- Hemaglutinina filamentoasă (purtată de pili). Permite ataşarea bacteriei la celulele epiteliale ciliate ale tractului respirator, de asemenea se fixează pe macrofage şi limfocite.
Слайд 106Aglutinogene. Proteine de suprafaţă situate pe fimbrii. Participă la ataşarea B.pertussis la

celulele epiteliale.
Pertactina. Proteină a membranei externe, permite fixarea pe membrana celulelor eucariote
Subunitatea B a toxinei pertusice. determină adeziunea bacteriei la epiteliul traheal şi celule fagocitare.
Слайд 1072. Toxine
Toxina pertussis (citotoxină de tip A-B). Poate fi fixată pe

suprafaţa bacteriei sau secretată în spaţiul extracelular. Acţionează asupra diferitor celule eucariote, mărind concentraţia intracelulară de AMP ciclic (fragmentul A este o ADP ribosil transferază). Provoacă hiperlimfocitoză, sensibilizare la histamină, hipersecreţie de insulină, perturbarea activităţii fagocitelor.
Adenilat-ciclaza-hemolizină. Provoacă hemoliză, perturbă activitatea bactericidă a PMN, monocitelor şi macrofagelor şi stimulează secreţia sero-mucoasă a căilor respiratorii.
Слайд 108Toxina dermonecrotică. Se eliberează în urma lizei bacteriene. Determină inflamaţie şi necroză

locală.
Toxina citotraheală. Glicopeptid (fragmente de peptidoglican) care inhibă sinteza ADN, provocând distrugerea celulelor epiteliale ciliate. Stimulează eliminarea IL-1, cauzând febră.
Endotoxina
Patogeneza tusei convulsive
Sursa de infecţie – omul bolnav, în special în perioada de debut al bolii.
Mecanismul de transmitere – aerogen, prin picături
Слайд 110B.pertussis manifestă tropism pentru mucoasa căilor respiratorii: faringe, trahee, bronşii, bronhiole, chiar

alveole. Alterarea epiteliului ciliat împiedică eliminarea mucusului, el fiind eliminat doar prin tuse. Tusea survine din cauza iritaţiei mucoasei de către toxina bacteriană. Excitaţia de lungă durată a receptorilor terminali ai nervului pneumogastric determină un flux continuu de impulsuri în bulbul rahidian, ce duce la formarea unui focar de excitaţie dominant. El atrage excitaţii nespecifice de la alţi receptori, fapt ce determină accesele de tuse, care devin tot mai grave şi mai frecvente.
Слайд 112Un stimul puternic poate stinge dominanta, cu atenuarea tusei. Focarul este foarte

stabil, persistă şi după dispariţia bacteriei din organism.
În evoluţia tusei convulsive se disting 4 stadii (perioade):
Perioada de incubaţie (3-15 zile)
Perioada catarală, foarte contagioasă. Caracterizată prin tuse seacă, rinoree (3-14 zile)
Perioada convulsivă (paroxistică). Accese de tuse spasmodică, epuizantă, asociată cu cianoză, vomă, convulsii. (2-4 săptămâni)
Perioada de convalescenţă (2-4 săptămâni)
Слайд 114Complicaţii grave sunt posibile la copiii sugari: bronho-pneumonii, encefalite.
Imunitatea este durabilă, umorală

şi celulară. Rol protector au Ac anti-toxină pertussis şi anti-hemaglutinină filamentoasă.
Слайд 115Diagnosticul de laborator
al tusei convulsive
Prelevate: mucozităţi nasofaringiene sau bronşice, recoltate cât

mai precoce.
Metode de diagnostic
RIF
Examenul bacteriologic (însămânţare cu tamponul sau prin tehnică “plăcilor tuşite”)
Tehnnici de biologie moleculară (PCR)
Examenul serologic (RA, ELISA). Reacţiile se pozitivează din săptămâna a II a perioadei convulsive. Se examinează seruri perechi prelevate la interval de 14-21 zile. Semnificativă este o creştere de cel puţin 4 ori a titrului Ac.



































































 Балалар гинекологиясының негіздері
Балалар гинекологиясының негіздері Нарушения поведения при аффективных расстройствах. Биполярное расстройство
Нарушения поведения при аффективных расстройствах. Биполярное расстройство Основные виды отклонений в развитии. Лекции 2
Основные виды отклонений в развитии. Лекции 2 Ликвор, технология получения, виды
Ликвор, технология получения, виды Эндокринная система человека
Эндокринная система человека Лига С по современному мечевому бою
Лига С по современному мечевому бою Вахта трехлистная
Вахта трехлистная Cholangicarcinoma
Cholangicarcinoma Жедел медициналық көмек
Жедел медициналық көмек Медицина 21 века
Медицина 21 века Мягкое кесарево сечение
Мягкое кесарево сечение crv4r
crv4r Методы самоконтроля состояния здоровья и физического развития
Методы самоконтроля состояния здоровья и физического развития Здоровый образ жизни
Здоровый образ жизни Бутират. Оксибутират натрия
Бутират. Оксибутират натрия Компьютерные технологии в изучении дисциплины Основы сестринского дела
Компьютерные технологии в изучении дисциплины Основы сестринского дела Проучване на анти-N антитела срещу Коронавирус
Проучване на анти-N антитела срещу Коронавирус Факторы окклюзии
Факторы окклюзии Гиперпролактинемия
Гиперпролактинемия Медицинское освидетельствование при первоначальной постановке на воинский учет
Медицинское освидетельствование при первоначальной постановке на воинский учет Клинический случай. Смерть ребёнка 19 дней, у несовершеннолетней матери (15 лет)
Клинический случай. Смерть ребёнка 19 дней, у несовершеннолетней матери (15 лет) Природа, механизмы и критерии старения
Природа, механизмы и критерии старения Взаимосвязь возникновения пародонтоза и атеросклеротических заболеваний
Взаимосвязь возникновения пародонтоза и атеросклеротических заболеваний IMMUNOPATOLOGIYa_pptx1
IMMUNOPATOLOGIYa_pptx1 Листерии
Листерии Изменения в организме при беременности желудочно-кишечного тракта
Изменения в организме при беременности желудочно-кишечного тракта Сочетанные поражения венечных и магистральных артерий
Сочетанные поражения венечных и магистральных артерий Беда по имени СПИД
Беда по имени СПИД