Мононуклеарные клетки пуповинной крови, экспрессирующие фактор роста нервов,для коррекции патологии в модели болезни Альцгеймера
Содержание
- 2. Болезнь Альцгеймера – прогрессирующее неизлечимое нейродегенеративное заболевание, главным проявлением которого является деменция. Перспективным направлением в разработке
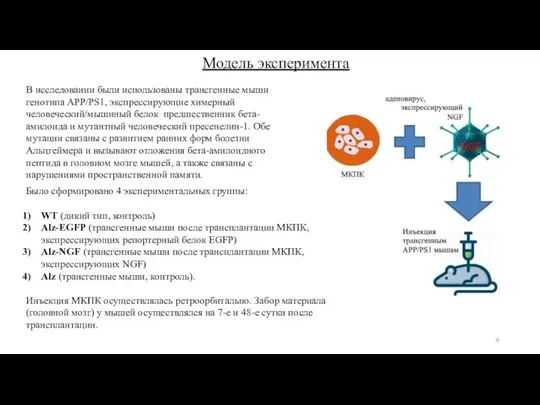
- 3. Целью данной работы явилась оценка терапевтического потенциала МКПК, трансдуцированных аденовирусами, экспрессирующими фактор роста нервов (NGF) на
- 4. Было сформировано 4 экспериментальных группы: WT (дикий тип, контроль) Alz-EGFP (трансгенные мыши после трансплантации МКПК, экспрессирующих
- 5. Методика иммуногистохимического окрашивания: День 1 День 2 Промывка в PBST (4 раза по 5 мин) Инкубация
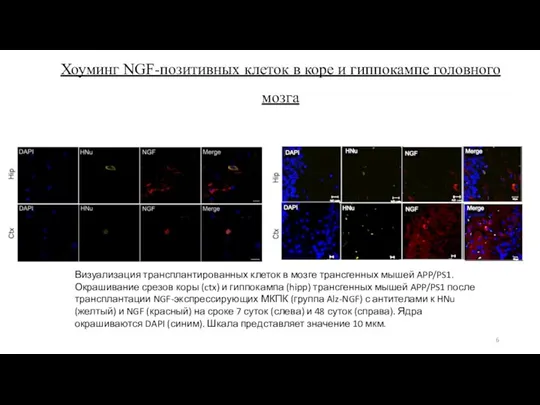
- 6. Хоуминг NGF-позитивных клеток в коре и гиппокампе головного мозга Визуализация трансплантированных клеток в мозге трансгенных мышей
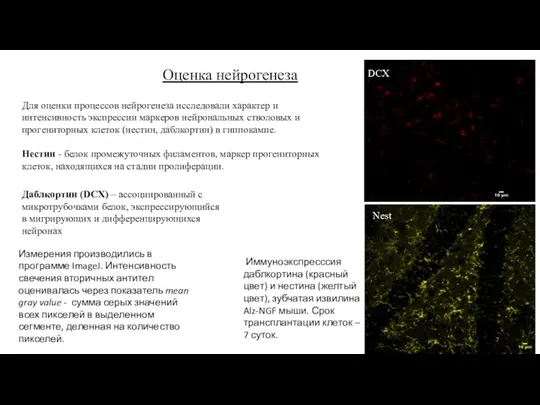
- 7. Оценка нейрогенеза Для оценки процессов нейрогенеза исследовали характер и интенсивность экспрессии маркеров нейрональных стволовых и прогениторных
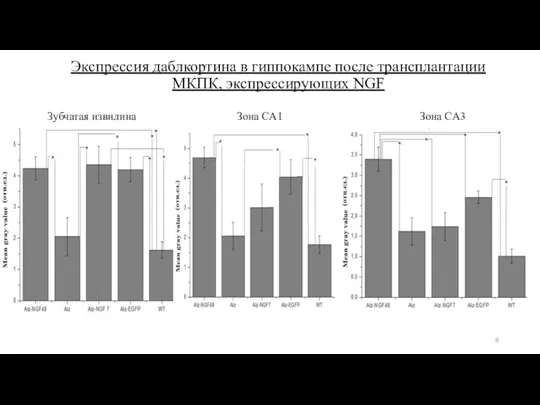
- 8. Экспрессия даблкортина в гиппокампе после трансплантации МКПК, экспрессирующих NGF Зубчатая извилина Зона CA1 Зона CA3
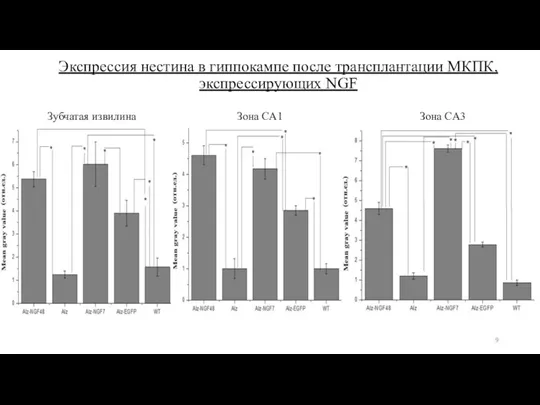
- 9. Экспрессия нестина в гиппокампе после трансплантации МКПК, экспрессирующих NGF Зубчатая извилина Зона CA1 Зона CA3
- 10. Выводы В ходе исследования были показаны: 1. Успешная трансплантация предложенного вектора и способность генно-клеточной конструкции к
- 11. Благодарности Выражается благодарность за помощь в подготовке и выполнении работы: Кафедре физиологии человека и животных КФУ
- 13. Скачать презентацию





 Вред и польза соли Учебный проект
Вред и польза соли Учебный проект столбняк
столбняк Антисептики
Антисептики Archie Cochrane
Archie Cochrane Гипопластическая, апластическая, дизэритропоэтическая анемии
Гипопластическая, апластическая, дизэритропоэтическая анемии Пищевые токсикоинфекции у беременных
Пищевые токсикоинфекции у беременных Морфофункциональная характеристика организма человека. Лекция 2
Морфофункциональная характеристика организма человека. Лекция 2 Роль гиперчувствительности замедленного типа в инфекционном процессе и нестерильном иммунитете
Роль гиперчувствительности замедленного типа в инфекционном процессе и нестерильном иммунитете Приход осени - сезон здоровья с Арт-Лайф
Приход осени - сезон здоровья с Арт-Лайф Таз с анатомической и акушерской точек зрения
Таз с анатомической и акушерской точек зрения Лекция2ПринцЛечНелин
Лекция2ПринцЛечНелин Предмет эпидемиологии заболеваемость
Предмет эпидемиологии заболеваемость Иридодиагностика. Поражение почек
Иридодиагностика. Поражение почек Диагностика и лечение молодых инсультов
Диагностика и лечение молодых инсультов 吉林展示会TV用
吉林展示会TV用 Гештальт-терапия
Гештальт-терапия Экссудативное воспаление
Экссудативное воспаление Диагностика детей с диагнозом ЗПР психогенного генеза
Диагностика детей с диагнозом ЗПР психогенного генеза Риск возникновения отдаленных осложнений перфорации барабанной перепонки у пациентов
Риск возникновения отдаленных осложнений перфорации барабанной перепонки у пациентов Хронический тонзиллит
Хронический тонзиллит Риногенные орбитальные осложнения
Риногенные орбитальные осложнения Первая помощь при отравлении
Первая помощь при отравлении Клиническая картина повреждения прямой кишки
Клиническая картина повреждения прямой кишки Клинический случай
Клинический случай Гипертония. Механизм развития гипертонии
Гипертония. Механизм развития гипертонии Здоровьесберегающие технологии на уроках математики
Здоровьесберегающие технологии на уроках математики Части тела
Части тела ДЕТСКИЙ КОНСУЛЬТАТИВНО-ДИАГНОСТИЧЕСКИЙ ЦЕНТР ФГУ НМХЦ ИМ. Н.И.ПИРОГОВА РОСЗДРАВА КАФЕДРА СОЦИАЛЬНОЙ ПЕДИАТРИИ института усоверш
ДЕТСКИЙ КОНСУЛЬТАТИВНО-ДИАГНОСТИЧЕСКИЙ ЦЕНТР ФГУ НМХЦ ИМ. Н.И.ПИРОГОВА РОСЗДРАВА КАФЕДРА СОЦИАЛЬНОЙ ПЕДИАТРИИ института усоверш