Содержание
- 2. 1. Фармаконадзор 2. Необходимость фармаконадзора 3. Исторические данные 4. Современная система фармаконадзора в мире 5. Цель
- 3. Фармаконадзор вид деятельности по мониторингу эффективности и безопасности лекарственных препаратов, направленный на выявление, оценку и предотвращение
- 4. Необходимость системы фармаконадзора 1) Клинические исследования проводятся в строго контролируемых условиях в течение относительно короткого промежутка
- 5. Исторические данные Стимулом к формированию системы фармаконадзора стала «талидомидовая трагедия»: 1 октября 1957 г. немецкая фирма
- 6. Талидомидовая трагедия
- 7. Талидомидовая трагедия В США, несмотря на давление со стороны фармкомпаний, Фрэнсис О. Келси, первая женщина-глава FDA,
- 8. Проблемы обращения лекарственных препаратов. Актуальность фармаконадзора Современный уровень проблемы по безопасности применения лекарственных препаратов в странах
- 9. Цель фармаконадзора Лекарственное средство считается безопасным для применения, если польза от его применения превышает риск. Эрвэ
- 10. Общая схема системы фармаконадзора в России
- 11. Средства фармаконадзора 1. Средства получения данных по безопасности фармаконадзора: 1.1 Сообщения от потребителей / пациентов/ медицинских
- 12. Извещение о нежелательных реакциях и отсутствии терапевтического действия
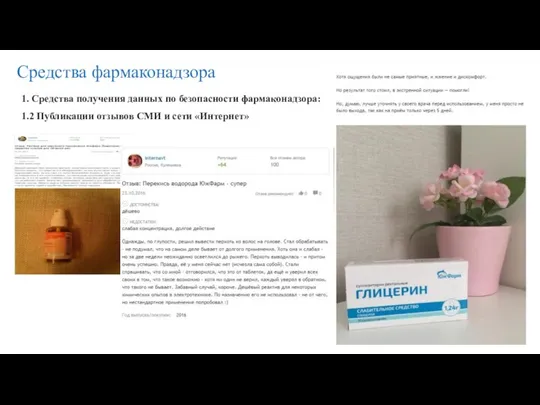
- 13. Средства фармаконадзора 1. Средства получения данных по безопасности фармаконадзора: 1.2 Публикации отзывов СМИ и сети «Интернет»
- 14. Средства фармаконадзора 1. Средства получения данных по безопасности фармаконадзора: 1.3 Публикации литературных данных: медицинские литературные обзоры,
- 15. Средства фармаконадзора 1. Средства получения данных по безопасности фармаконадзора: 1.4 Данные регуляторных органов
- 16. Средства фармаконадзора 1. Средства получения данных по безопасности фармаконадзора: 1.4 Претензии / вопросы и предложения от
- 17. Средства фармаконадзора 2. Выявление рисков / оценка риска / оценка соотношения «польза – риск»
- 18. Средства фармаконадзора 3. Минимизация выявленного риска / оценка соотношения «польза – риск» Примеры мер минимизация риска:
- 19. Средства фармаконадзора Например, внесение изменений в инструкцию по медицинскому применению как мера минимизации выявленного риска действующего
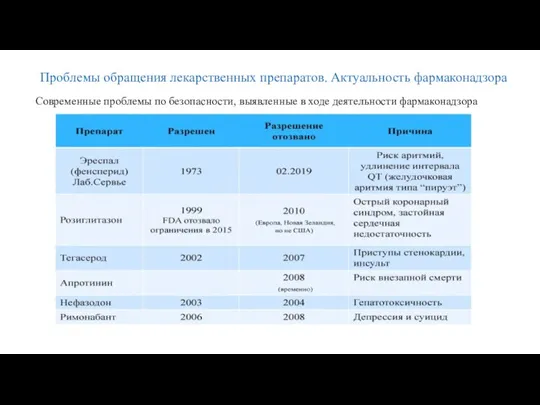
- 20. Современные проблемы по безопасности, выявленные в ходе деятельности фармаконадзора Проблемы обращения лекарственных препаратов. Актуальность фармаконадзора
- 21. Заключение описания деятельности фармаконадзора
- 22. Информирование о нежелательных реакциях Для предоставления данных по безопасности лекарственных средств в регуляторные органы, необходим заполнить
- 23. Извещение о нежелательных реакциях и отсутствии терапевтического действия
- 24. Ответственность Уголовный кодекс РФ Статья 237. Сокрытие информации об обстоятельствах, создающих опасность для жизни или здоровья
- 25. Ответственность КоАП Статья 19.7.8. Непредставление сведений или представление заведомо недостоверных сведений в федеральный орган исполнительной власти,
- 26. Ответственность Уголовный кодекс РФ Статья 238. Производство, хранение, перевозка либо сбыт товаров и продукции, выполнение работ
- 28. Скачать презентацию























 Всё ли мы знаем о ГЭРБ
Всё ли мы знаем о ГЭРБ HIFU-терапия. Что такое HIFU?
HIFU-терапия. Что такое HIFU? Преждевременный дородовый разрыв плодных оболочек
Преждевременный дородовый разрыв плодных оболочек Уход и наблюдение за детьми с заболеваниями ОМС
Уход и наблюдение за детьми с заболеваниями ОМС Құжат айналымының сандық және сапалық сипаттамасы. Медициналық ұйымдардағы құжат айналымын жетілдіру жодары мен тәсілдері
Құжат айналымының сандық және сапалық сипаттамасы. Медициналық ұйымдардағы құжат айналымын жетілдіру жодары мен тәсілдері Химия и здоровье
Химия и здоровье Обзор исследования DIGAMI: интенсивная терапия инсулином во время и после инфаркта миокарда у пациентов с диабетом
Обзор исследования DIGAMI: интенсивная терапия инсулином во время и после инфаркта миокарда у пациентов с диабетом Система и технологии коррекционной работы по преодолению заикания: Создание охранительного речевого режима
Система и технологии коррекционной работы по преодолению заикания: Создание охранительного речевого режима Остановка кровообращения, сердечно-легочная реанимация
Остановка кровообращения, сердечно-легочная реанимация Искривление позвоночника. Осанка и наличие плоскостопия
Искривление позвоночника. Осанка и наличие плоскостопия Средства для наркоза
Средства для наркоза Цирроз печени и гепатиты
Цирроз печени и гепатиты Понятие о шоке и меры его предупреждения. Простейшие способы реанимации на поле боя
Понятие о шоке и меры его предупреждения. Простейшие способы реанимации на поле боя Кровообращение плода
Кровообращение плода Vivasan у неврології
Vivasan у неврології Анализ показателей остроты зрения у детей общеобразовательных классов и классов с углубленным изучением информатики
Анализ показателей остроты зрения у детей общеобразовательных классов и классов с углубленным изучением информатики Uchenie_o_skeletnykh_myshtsakh
Uchenie_o_skeletnykh_myshtsakh Методы определения содержания активно действующего вещества в дезинфицирующих средствах и их растворах в ветеринарной практике
Методы определения содержания активно действующего вещества в дезинфицирующих средствах и их растворах в ветеринарной практике Ішек аностомозы
Ішек аностомозы ДБҚБ
ДБҚБ Психология в медицине
Психология в медицине Лимфатические сосуды и узлы верхних конечностей
Лимфатические сосуды и узлы верхних конечностей Гигиена сердечно-сосудистой системы
Гигиена сердечно-сосудистой системы Что такое грипп?
Что такое грипп? Общий анализ крови
Общий анализ крови Концептуальный аппарат нейропсихологии
Концептуальный аппарат нейропсихологии Перкуссия сердца
Перкуссия сердца ЗСН – застойная сердечная недостаточность
ЗСН – застойная сердечная недостаточность