Содержание
- 2. Вклад изменений терапии в продолжительность жизни больных[1] Литература Lopes-Pacheco M CFTR Modulators: Shedding Light on Precision
- 3. Классы мутаций гена CFTR [1,2] Литература : De Boeck K. Cystic fibrosis in the year 2020:
- 4. Новые рекомендации по диагностике и терапии муковисцидоза
- 5. Препараты, действие которых направлено на восстановление функции белка CFTR, называются CFTR-модуляторами Препараты для носителей генетического варианта
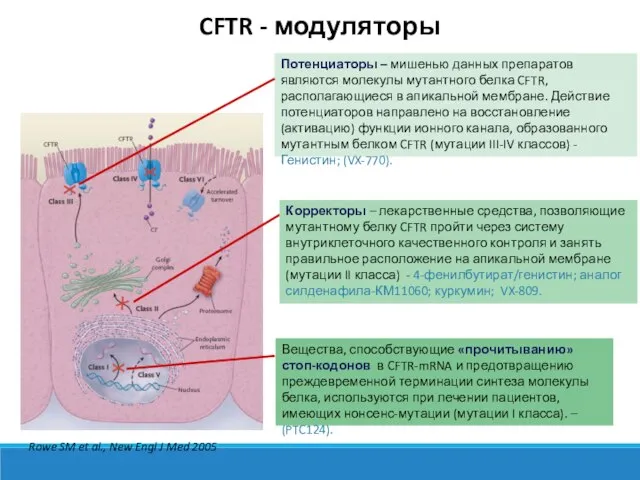
- 6. Rowe SM et al., New Engl J Med 2005 Потенциаторы – мишенью данных препаратов являются молекулы
- 7. Модуляторы мутаций III и VI классов гена CFTR [1] Литература Amaral M.D. Novel personalized therapies for
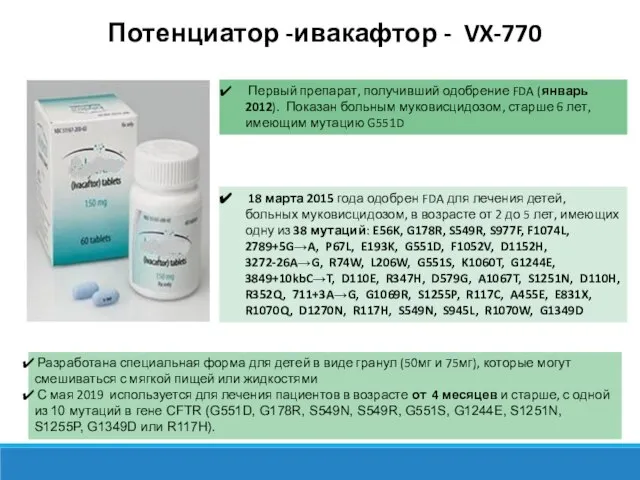
- 8. Потенциатор -ивакафтор - VX-770 Первый препарат, получивший одобрение FDA (январь 2012). Показан больным муковисцидозом, старше 6
- 9. Эффект потенциатора CFTR ивакаофтора у пациентов с другими генотипами, связанными с нарушением проводимости (не G551D)… Часть
- 10. Патогенетическая терапия Мутации II класса МЕХАНИЗМ Нарушение созревания и транспорта белка F508del, N1303K, I507del, S549I, S549R,
- 11. 3D-изображение белка Фодинг белка (укладка белка ( folding) - процесс спонтанного сворачивания полипептидной цепи в уникальную
- 12. 2 модулятор (1 корректор)- лумакафтор 2 –й препарат таргетной терапии lumacaftor / ivacaftor FDA впервые одобрило
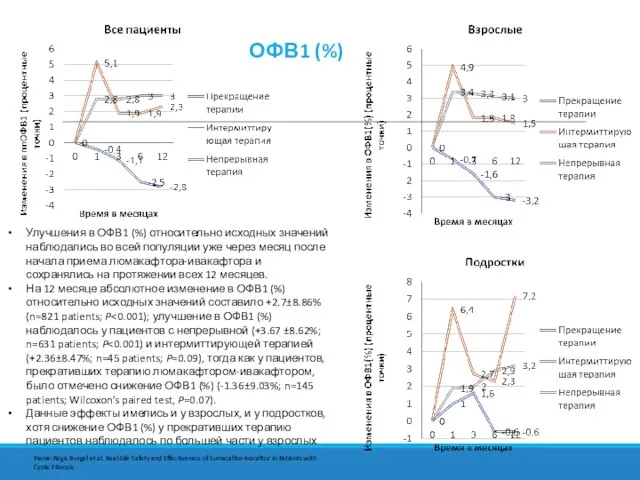
- 13. ОФВ1 (%) Улучшения в ОФВ1 (%) относительно исходных значений наблюдались во всей популяции уже через месяц
- 14. Комбинация ивакафтора (VX-770) и нового препарата тезакофтора (VX-661) Препарат для больных в возрасте 6 лет и
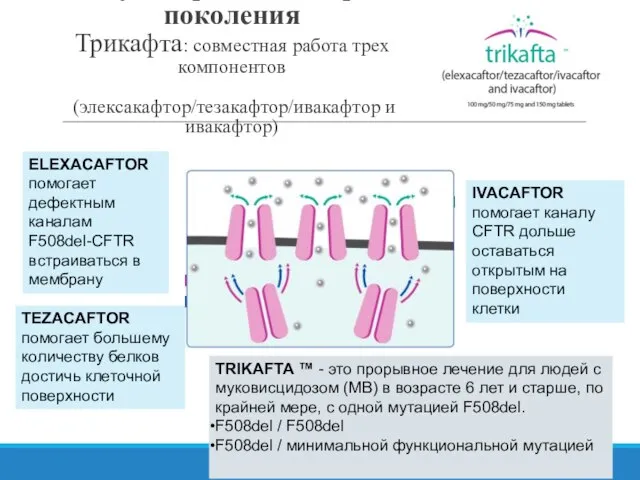
- 15. IVACAFTOR помогает каналу CFTR дольше оставаться открытым на поверхности клетки ELEXACAFTOR помогает дефектным каналам F508del-CFTR встраиваться
- 17. Культуры органоидов при ректальной биопсии лаборатория Генетики стволовых клеток ФГБНУ «МГНЦ» [1-5] В ФГБНУ «МГНЦ» поставлена
- 18. Медицинская информационная технология при муковисцидозе (HIT-CF). В результате работы программы уже были изменены инструкции к препаратам
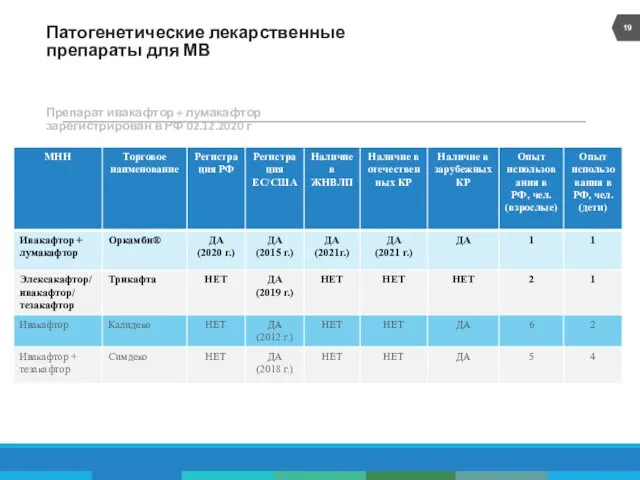
- 19. Патогенетические лекарственные препараты для МВ Препарат ивакафтор + лумакафтор зарегистрирован в РФ 02.12.2020 г
- 20. Критерии назначения ЛП элексакафтор/ивакафтор/тезакафтор Разработаны экспертным сообществом по муковисцидозу в т.ч. на основе Инструкции по МП
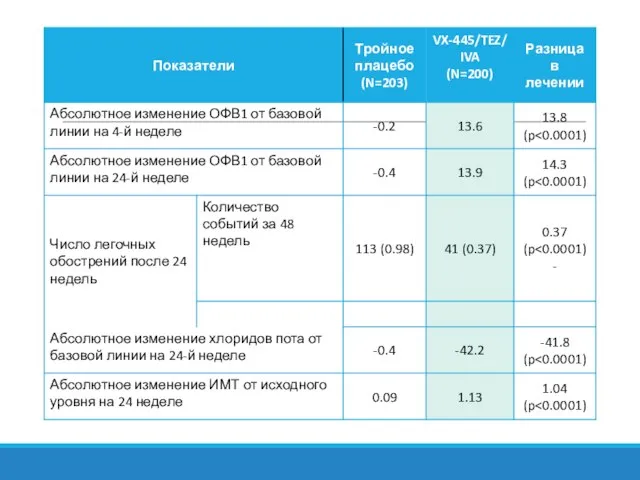
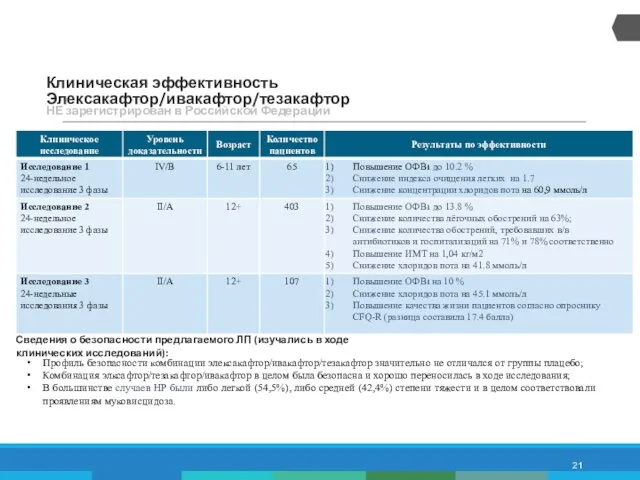
- 21. Клиническая эффективность Элексакафтор/ивакафтор/тезакафтор НЕ зарегистрирован в Российской Федерации Профиль безопасности комбинации элексакафтор/ивакафтор/тезакафтор значительно не отличался от
- 22. Клинические критерии и длительность, позволяющие оценить эффективность проводимого лечения Для пациентов, получающих терапию за счет средств
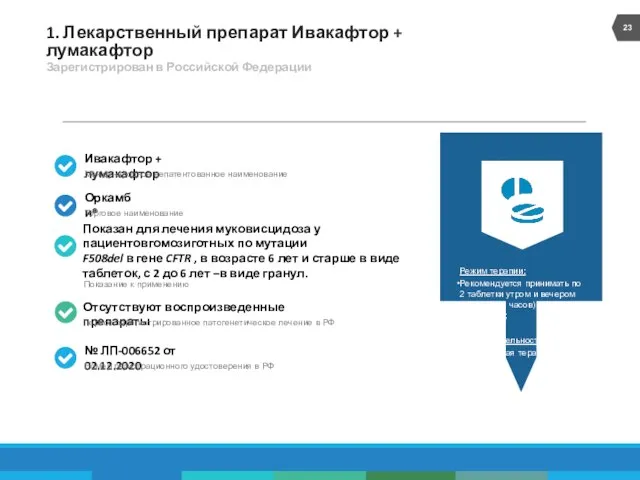
- 23. 1. Лекарственный препарат Ивакафтор + лумакафтор Зарегистрирован в Российской Федерации Режим терапии: Рекомендуется принимать по 2
- 24. Модуляторы мутаций II класса гена CFTR [1] Литература Amaral M.D. Novel personalized therapies for cystic fibrosis:
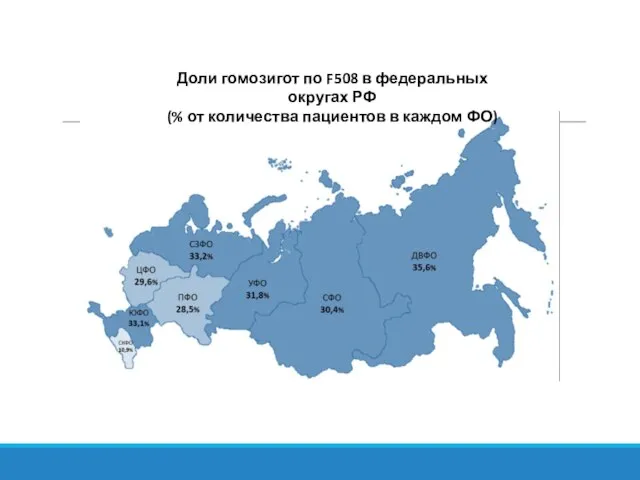
- 25. Доли гомозигот по F508 в федеральных округах РФ (% от количества пациентов в каждом ФО)
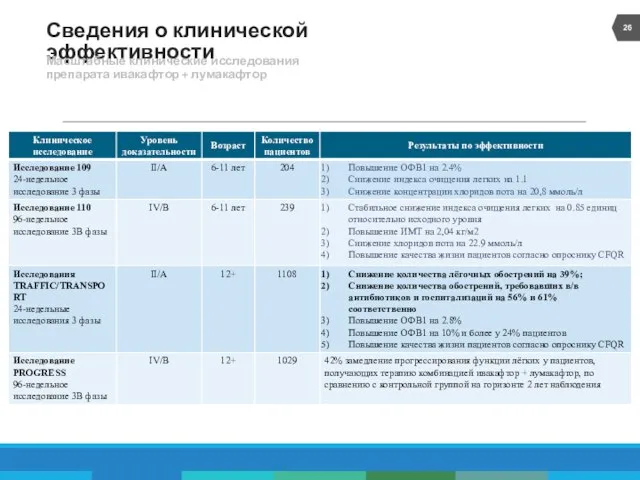
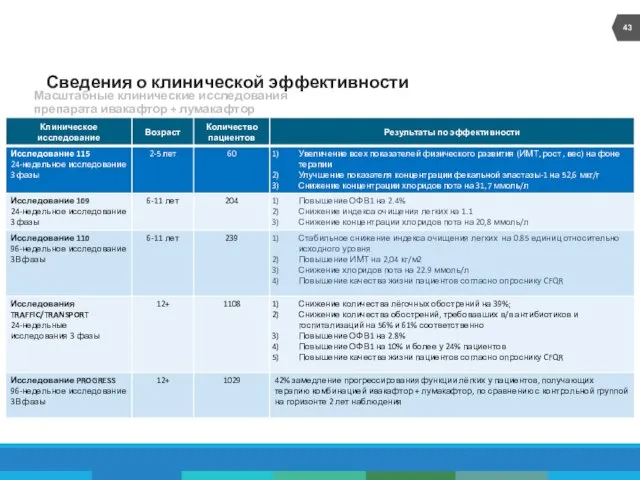
- 26. Сведения о клинической эффективности Масштабные клинические исследования препарата ивакафтор + лумакафтор
- 27. Исследования ТРАФФИК/ТРАНСПОРТ: дизайн Два этапа, рандомизированные, двойные слепые, плацебо-контролируемые исследования в параллельных группах Пациенты, которые завершили
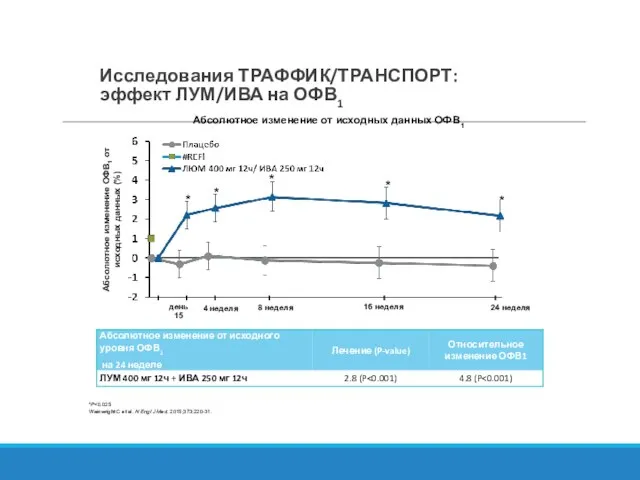
- 28. Исследования ТРАФФИК/ТРАНСПОРТ: эффект ЛУМ/ИВА на ОФВ1 *P Wainwright C et al. N Engl J Med. 2015;373:220-31.
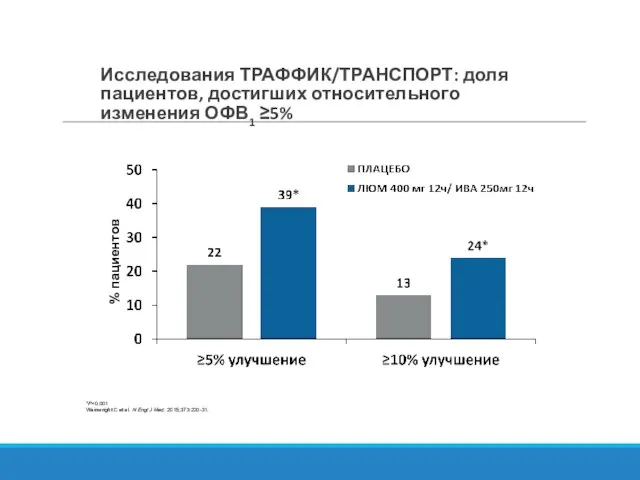
- 29. Исследования ТРАФФИК/ТРАНСПОРТ: доля пациентов, достигших относительного изменения ОФВ1 ≥5% *P Wainwright C et al. N Engl
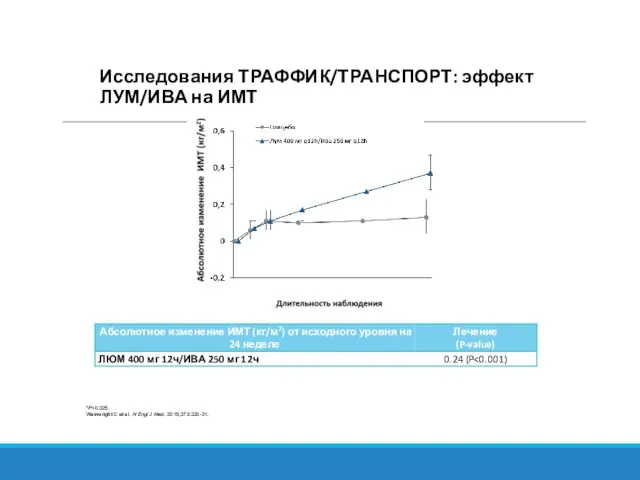
- 30. *P Wainwright C et al. N Engl J Med. 2015;373:220-31. Исследования ТРАФФИК/ТРАНСПОРТ: эффект ЛУМ/ИВА на ИМТ
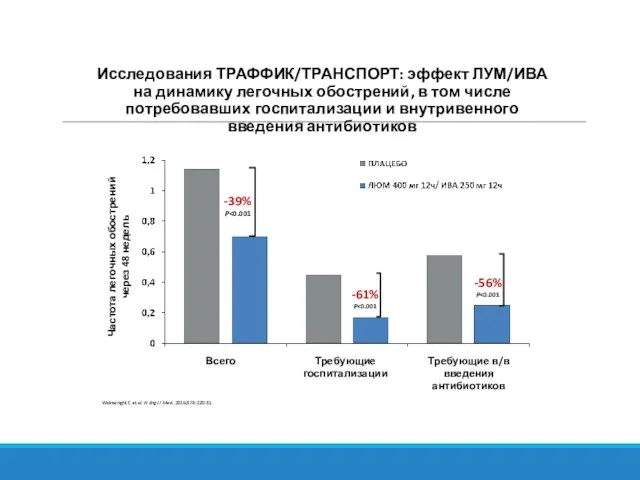
- 31. Исследования ТРАФФИК/ТРАНСПОРТ: эффект ЛУМ/ИВА на динамику легочных обострений, в том числе потребовавших госпитализации и внутривенного введения
- 32. 3.1 Консервативное лечение 3.1.1. Патогенетическая терапия CFTR модуляторами Рекомендуется применение комбинации ивакафтор+лумакафтор (лумакафтор (корректор белка CFTR)
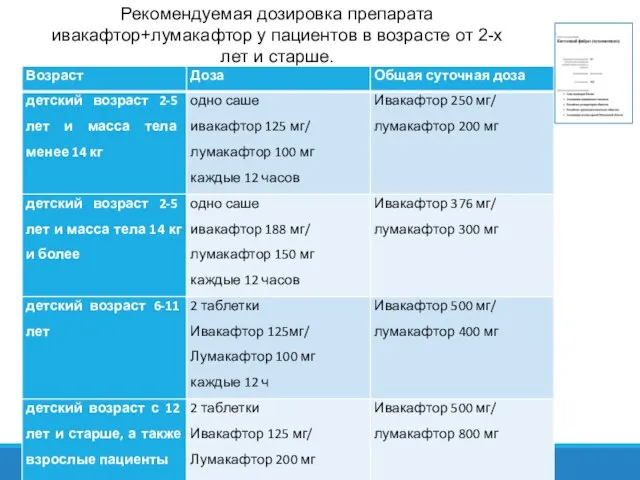
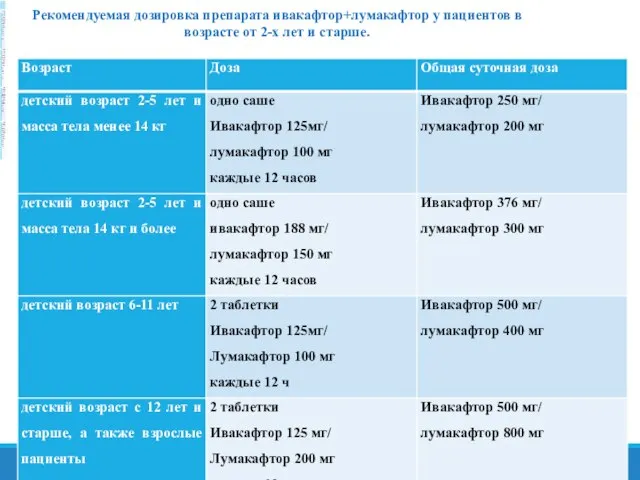
- 33. Рекомендуемая дозировка препарата ивакафтор+лумакафтор у пациентов в возрасте от 2-х лет и старше.
- 34. Методы подбора патогенетической терапии (ивакафтор+лумакафтор) Комментарии: При назначении препарата ивакафтор+лумакафтор рекомендуется иметь данные о гетерозиготном носительстве
- 35. Выявлено 30 гетерозиготных носителей L467F (~ 10 %) Частота встречаемости комплексного аллеля p.[Leu467Phe;Phe508del] среди пациентов с
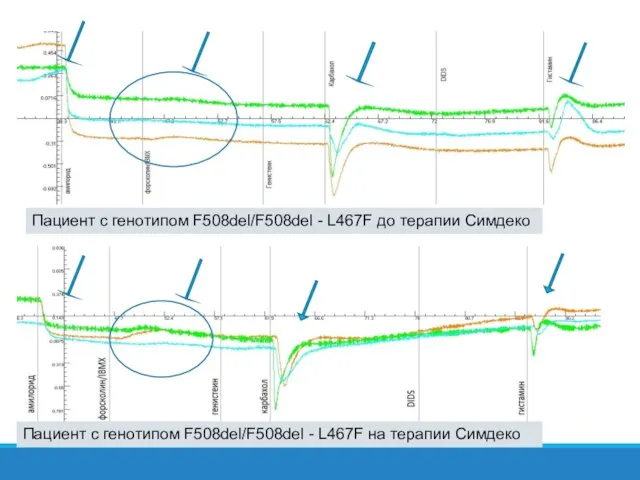
- 36. Пациент с генотипом F508del/F508del - L467F до терапии Симдеко Пациент с генотипом F508del/F508del - L467F на
- 37. Результаты метода определения разности кишечных потенциалов (после терапии Симдеко) при добавлении амилорида наблюдается снижение тока короткого
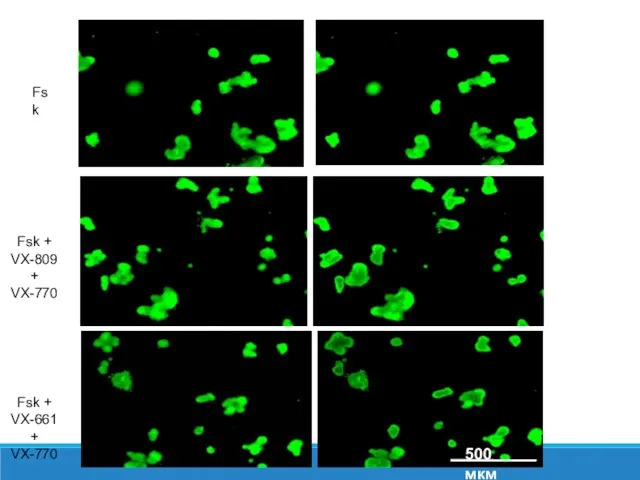
- 38. 90 мин 0 мин Fsk + VX-770 Fsk + VX-809 + VX-770 Fsk Fsk + VX-661
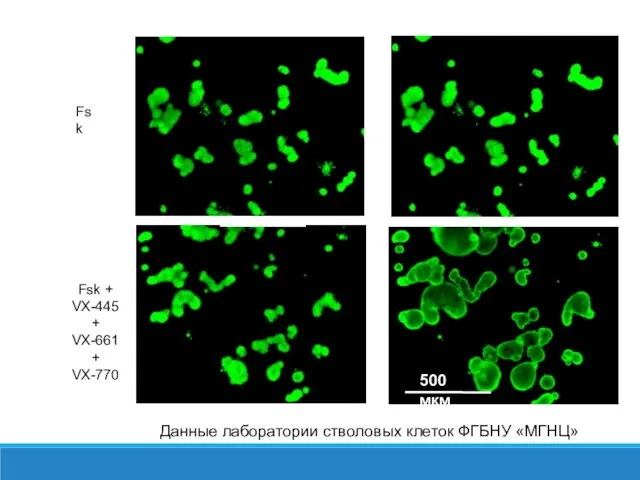
- 39. 90 мин 0 мин Fsk Fsk + VX-445 + VX-661 + VX-770 Данные лаборатории стволовых клеток
- 40. Оценивали ответ кишечных органоидов, от пациентов с комплексным аллелем на введение корректора/потенциатора - VX-809 / VX-770.
- 41. 13 мая 2021 на заседании Экспертного совета Фонда поддержки детей с тяжелыми жизнеугрожающими и хроническими заболеваниями,
- 42. Лекарственный препарат Ивакафтор + лумакафтор (гранулы) Зарегистрирован в Российской Федерации Режим терапии: Рекомендуется принимать по саше
- 43. Сведения о клинической эффективности Масштабные клинические исследования препарата ивакафтор + лумакафтор
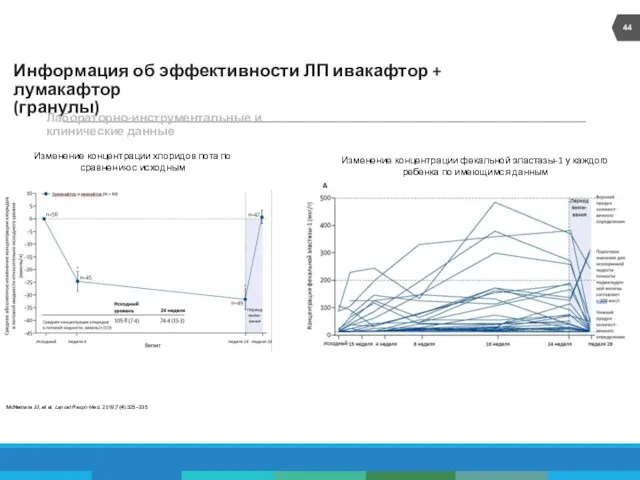
- 44. Информация об эффективности ЛП ивакафтор + лумакафтор (гранулы) Лабораторно-инструментальные и клинические данные Изменение концентрации хлоридов пота
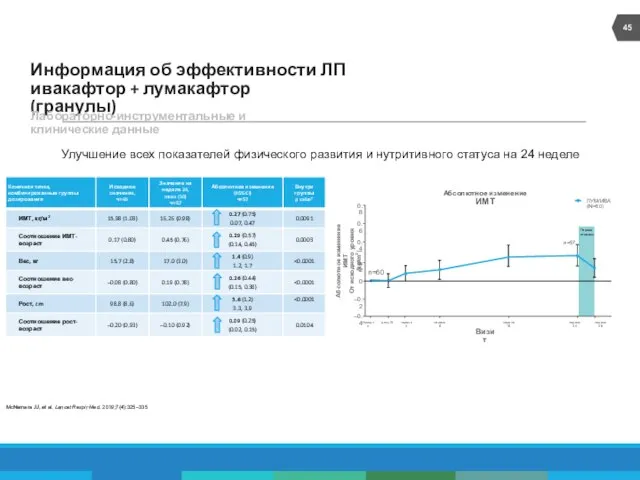
- 45. Информация об эффективности ЛП ивакафтор + лумакафтор (гранулы) Лабораторно-инструментальные и клинические данные Улучшение всех показателей физического
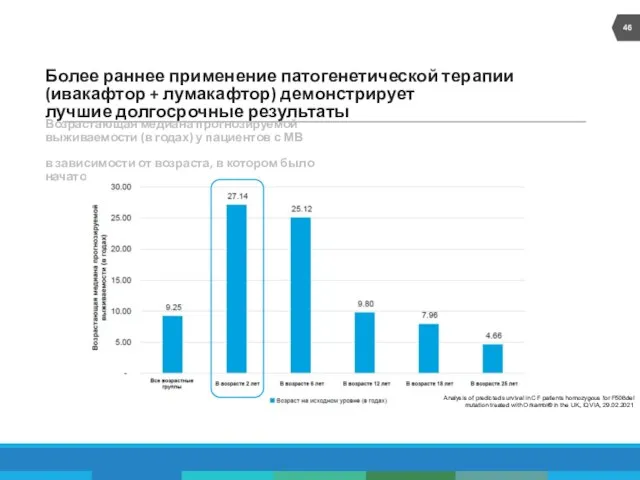
- 46. Более раннее применение патогенетической терапии (ивакафтор + лумакафтор) демонстрирует лучшие долгосрочные результаты Возрастающая медиана прогнозируемой выживаемости
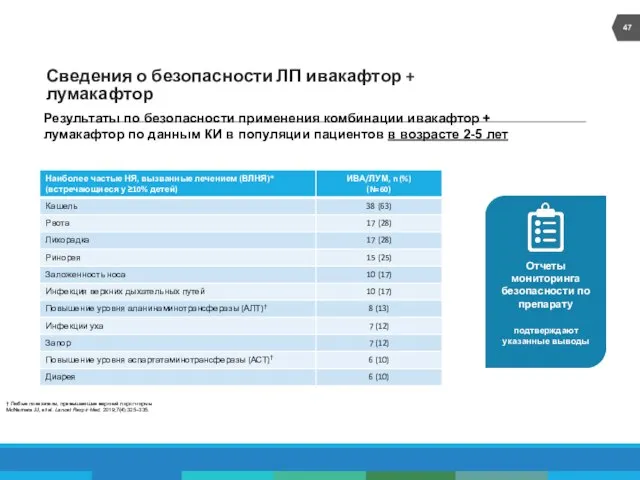
- 47. Сведения о безопасности ЛП ивакафтор + лумакафтор Результаты по безопасности применения комбинации ивакафтор + лумакафтор по
- 48. Дети, находящиеся в жизнеугрожающем состоянии без патогенетического лечения Дети, требующие лечения ивакафтор + лумакафтор 2-18 лет
- 49. Противопоказания Детский возраст до 2 лет для лекарственной формы в гранулах; Детский возраст до 6 лет
- 50. Эффективность терапии : следует оценивать через 6 месяцев по снижению числа обострений, потребности в АБТ, функциональным
- 51. При отсутствии эффекта через 6 месяцев терапии препаратом ивакафтор+лумакафтор необходимо: дополнительное обследование на носительство комплексного аллеля
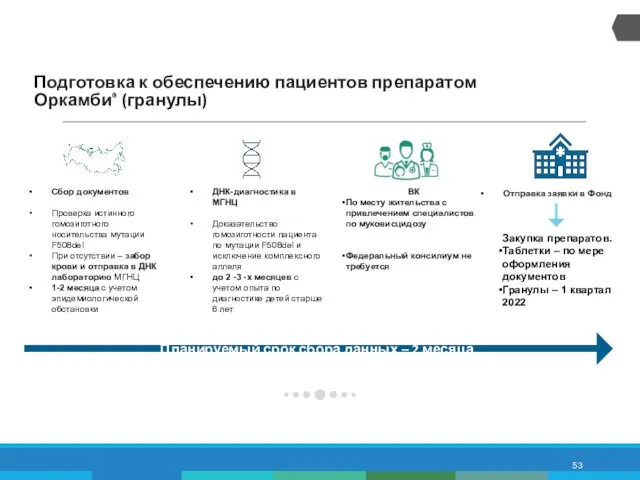
- 53. Подготовка к обеспечению пациентов препаратом Оркамби® (гранулы) Сбор документов Проверка истинного гомозиготного носительства мутации F508del При
- 55. Старт таргетной терапии КСГ ds35.003 (дневной стационар) для пациентов с сохранной функцией внешнего дыхания и стабильным
- 56. Нахождения пациентов с МВ в стационаре (согласно клиническим рекомендациям и СанПиНам) Наблюдение за пациентом и контроль
- 57. Показания Противопоказания Дозировка Режим приема Правила приема Взаимодействие с другими лекарственными препаратами НПЯ Контроль эффективности Какие
- 58. Показания Генотип – гомозигота по F508del Доказанная гомозиготность Отсутствие комплексного аллеля p.[Leu467Phe;Phe508del] Возраст от 2 лет
- 59. Снижается эффективность препаратов при приеме Оркамби Монтелукаст Фексофенадин (блокатор Н 1 гистаминовых рецепторов) Эритромицин Кларитромицин (можно
- 60. Торговое наименование: Оркамби®. Международное непатентованное или группировочное наименование: ивакафтор + лумакафтор Лекарственная форма: таблетки, покрытые пленочной
- 61. Рекомендуемая дозировка препарата ивакафтор+лумакафтор у пациентов в возрасте от 2-х лет и старше.
- 62. До первого приема препарата необходимо Для исключения противопоказаний Биохимический ан крови – минимальные исследования АЛТ, АСТ,
- 63. С осторожностью При тяжелой почечной недостаточности или терминальной стадии заболевания почек; При почечной недостаточности легкой и
- 64. Режим приема Каждые 12 часов ≠ 2 раза в день Необходимо употреблять жиросодержащую пищу непосредственно перед
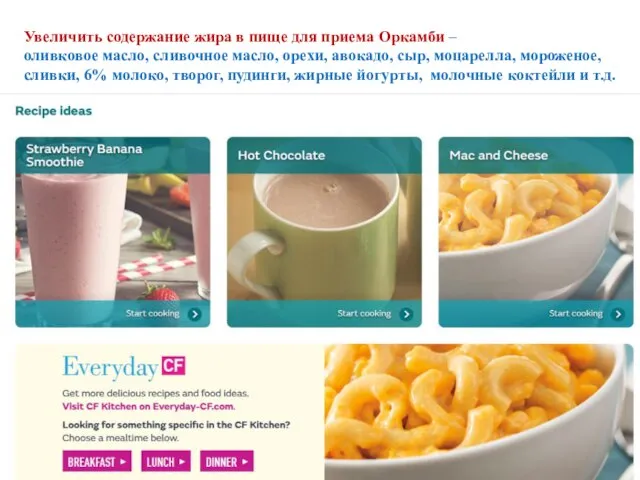
- 65. Увеличить содержание жира в пище для приема Оркамби – оливковое масло, сливочное масло, орехи, авокадо, сыр,
- 66. Если пациент пропустил время приема Оркамби! Менее 6 часов – следует принять препарат в обычной дозировке.
- 67. Одышка Кашель Бронхоспазм Увеличение мокроты заложенность носа, Кровохаркание Пневмоторакс Желудочно-кишечные (диарея, боли в животе) Миалгии Лихорадка
- 68. Что делать при НПЯ Наблюдение в условиях дневного стационара Оценка тяжести Обследование Симптоматическая терапия Коррекция дозировки
- 69. Контроль эффективности Через 2 недели оценка самочувствия, состояние, жалобы, вес, рост, ИМТ, ФВД, АД, потовый тест,
- 70. проведения теста кишечных потенциалов по показаниям проведение теста кишечных органоидов для определения чувствительности к другим модуляторам
- 71. Сейчас у нас больше вопросов, чем ответов. Мы все в начале пути. Нам в помощь мировой
- 73. Скачать презентацию
![Вклад изменений терапии в продолжительность жизни больных[1] Литература Lopes-Pacheco M CFTR Modulators:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/908979/slide-1.jpg)
![Классы мутаций гена CFTR [1,2] Литература : De Boeck K. Cystic fibrosis](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/908979/slide-2.jpg)


![Модуляторы мутаций III и VI классов гена CFTR [1] Литература Amaral M.D.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/908979/slide-6.jpg)





![Культуры органоидов при ректальной биопсии лаборатория Генетики стволовых клеток ФГБНУ «МГНЦ» [1-5]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/908979/slide-16.jpg)



![Модуляторы мутаций II класса гена CFTR [1] Литература Amaral M.D. Novel personalized](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/908979/slide-23.jpg)















![Показания Генотип – гомозигота по F508del Доказанная гомозиготность Отсутствие комплексного аллеля p.[Leu467Phe;Phe508del]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/908979/slide-57.jpg)











 Меры безопасности при сильном морозе
Меры безопасности при сильном морозе Дієта при гастриті
Дієта при гастриті Санаторий Сосны в Республике Беларусь
Санаторий Сосны в Республике Беларусь Асептика и антисептика. Профилактика хирургической инфекции
Асептика и антисептика. Профилактика хирургической инфекции Геномные болезни
Геномные болезни Приспособительные и компенсаторные процессы
Приспособительные и компенсаторные процессы Hemolytic anemia
Hemolytic anemia Основные вопросы по патофизиологии, входящие в лицензионный экзамен Крок-1. (Тема 10)
Основные вопросы по патофизиологии, входящие в лицензионный экзамен Крок-1. (Тема 10) Инфекционные заболевания, наиболее частым путём заражения которых является половой контакт
Инфекционные заболевания, наиболее частым путём заражения которых является половой контакт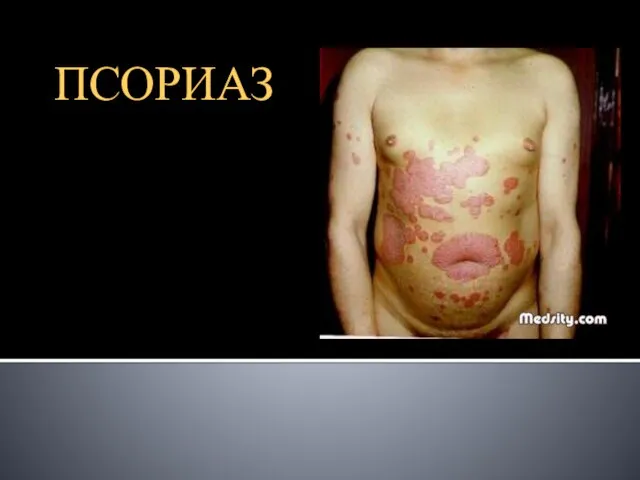 Псориаз
Псориаз 04 Параллелометрия
04 Параллелометрия БАБЖ бойынша “Диарея” жүргізу
БАБЖ бойынша “Диарея” жүргізу Общая хирургия и основы операционного процесса
Общая хирургия и основы операционного процесса Оказание первой помощи при кровотечениях, сдавлениях тела, растяжениях, ушибах, переломах, вывихах
Оказание первой помощи при кровотечениях, сдавлениях тела, растяжениях, ушибах, переломах, вывихах Қант диабеті
Қант диабеті Лечебно-охранительный режим и его компоненты
Лечебно-охранительный режим и его компоненты Сестринская деятельность в решении проблем детей с сахарным диабетом i типа в условиях поликлиники
Сестринская деятельность в решении проблем детей с сахарным диабетом i типа в условиях поликлиники Эмфизема легких
Эмфизема легких Число 9. Девятый
Число 9. Девятый Вступление к TCCC. Тактическая помощь пострадавшим в бою для медицинского персонала
Вступление к TCCC. Тактическая помощь пострадавшим в бою для медицинского персонала Определение понятий иридоиды и горечи
Определение понятий иридоиды и горечи Рак печени
Рак печени Stabilometry
Stabilometry Роль цитокинов в патогенезе заболеваний человека
Роль цитокинов в патогенезе заболеваний человека Сравнительная характеристика генных и хромосомных болезней
Сравнительная характеристика генных и хромосомных болезней Роль и значение биологически активных добавок к пище в жизни современного человека
Роль и значение биологически активных добавок к пище в жизни современного человека Профилактика и коррекция плоскостопия
Профилактика и коррекция плоскостопия L4_Osn_uchenia_ob_epid_protsesse
L4_Osn_uchenia_ob_epid_protsesse