Содержание
- 2. Из истории химических имён. Строение молекулы аммиака. Физические свойства аммиака. Действие на организм. Правила обращения с
- 3. Бог Амон в образе барана VIII в. до н.э. (Музей г. Мероэ, Судан)
- 4. N H 3
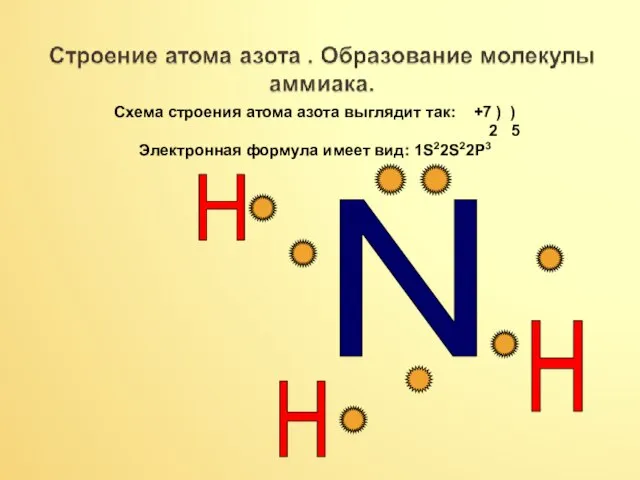
- 5. N H H H Схема строения атома азота выглядит так: +7 ) ) 2 5 Электронная
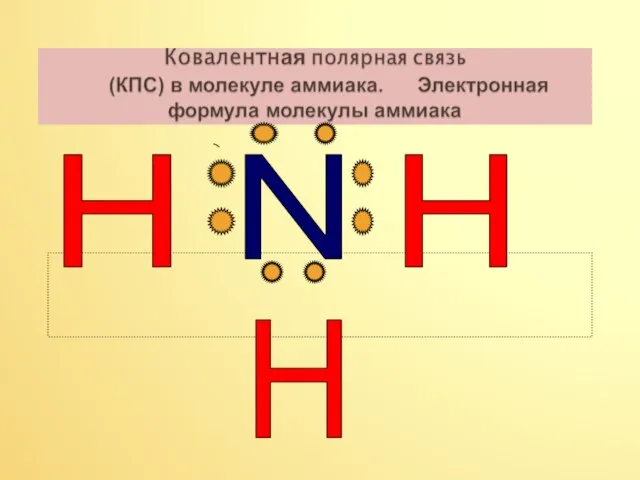
- 7. N H H H
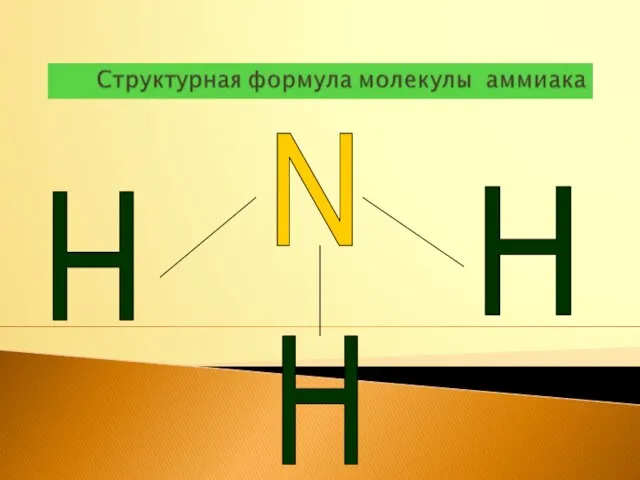
- 8. N H H H
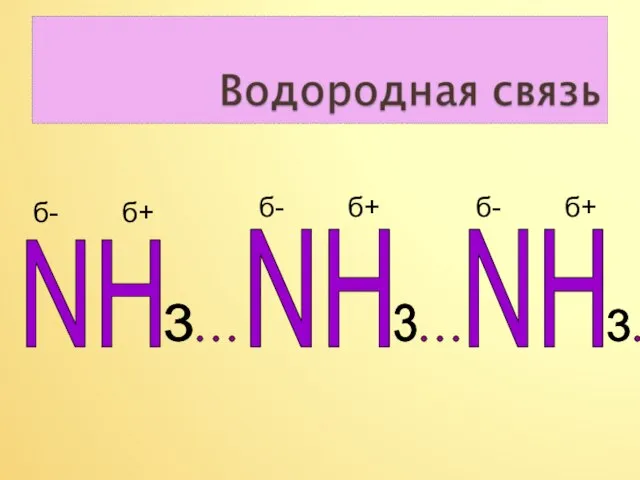
- 10. NH NH 3 3 3 NH б- б+ б- б+ б- б+
- 11. Вывод. Наличие не поделённой электронной пары на атоме азота и присутствие трёх полярных ковалентных связей в
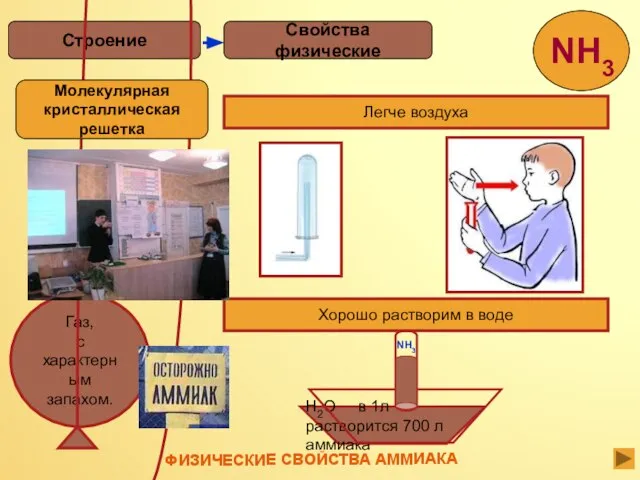
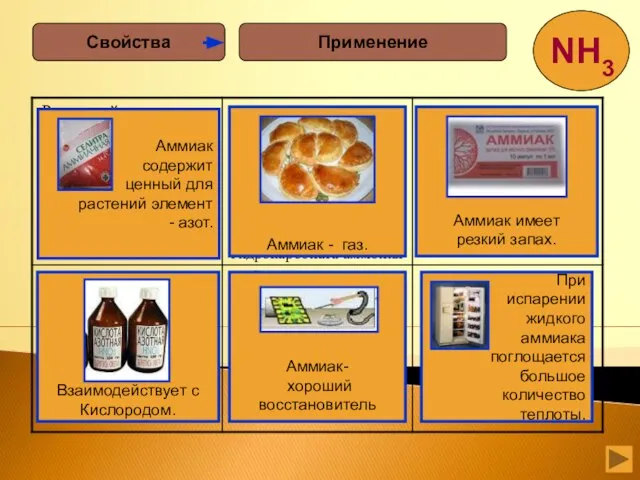
- 12. Аммиак –это газ, бесцветный, с резким запахом, ядовит, сжижается при –33,35 °С, затвердевает при –77,7 °С.
- 13. Свойства физические Строение Легче воздуха Хорошо растворим в воде H2O в 1л растворится 700 л аммиака
- 14. 1.Взаимодействие с водой. Действие водного раствора аммиака на индикаторы. 2.Взаимодействие с кислотами 3.Окисление: без катализатора; с
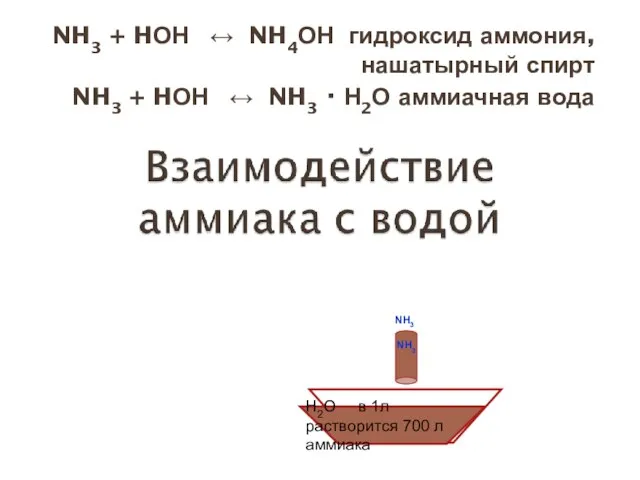
- 16. NH3 + HОН ↔ NH4ОН гидроксид аммония, нашатырный спирт NH3 + HОН ↔ NH3 · Н2О
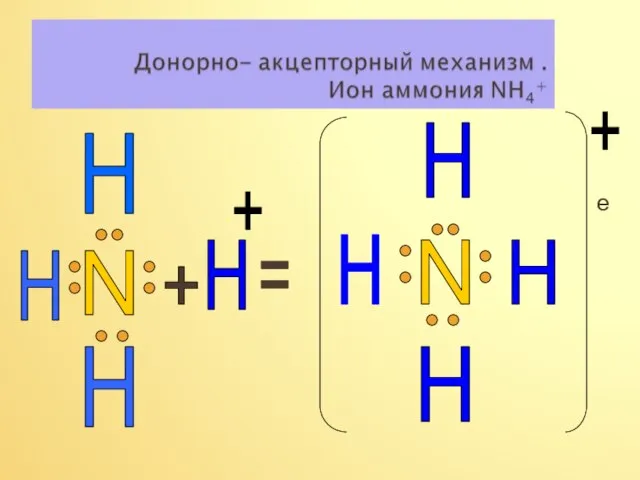
- 17. е N H H H H + = N H H H H + +
- 18. Растворение аммиака в воде и в кислотах – процесс химический, в основе которого лежит способность молекул
- 19. NH3 + HCl → NH4Cl. хлорид аммония( нашатырь) 2 NH3 + H2SO4 → (NH4)2 SO4 сульфат
- 20. 1. В отсутствии катализатора NH3 + O2 → N2 + H2O 4NH3 + 3O2 = 2N2
- 21. Аммиак не горит на воздухе, но в чистом кислороде или в присутствии катализатора аммиак хорошо окисляется,
- 22. . CuSO4 +2NaOH→Cu(OH)2+Na2SO4 4NH3+ Cu(OH)2→[Cu(NH3)4](OH)2
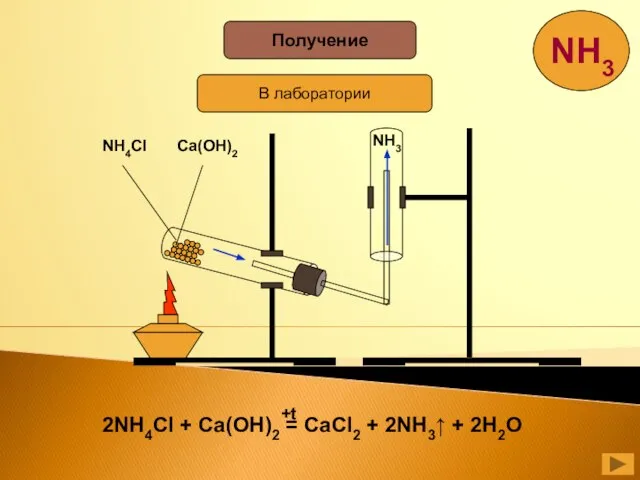
- 23. Получение В лаборатории NH4Cl Ca(OH)2 NH3
- 24. N + 3H = 2NH 2 2 3
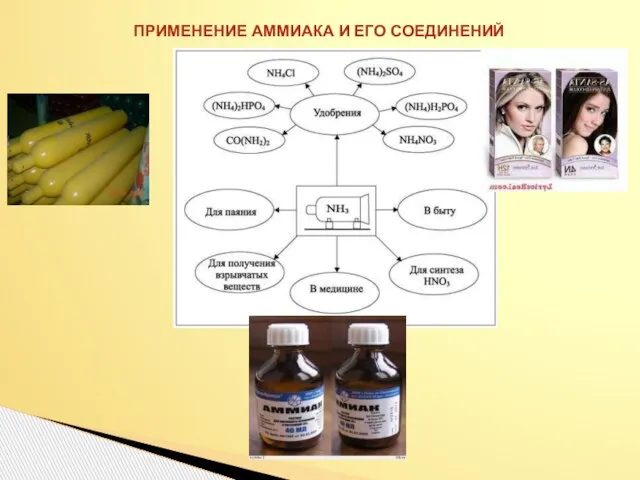
- 25. Применение Свойства
- 26. Чтоб продукты не пропали Вам поможет аммиак, И растениям, конечно, Аммиак совсем не враг. Если обморок
- 27. ПРИМЕНЕНИЕ АММИАКА И ЕГО СОЕДИНЕНИЙ
- 30. Нельзя прикасаться к разлитому веществу, это может вызвать болезненный ожог кожных покровов. При утечке аммиака важно
- 31. Контроль по теме «Аммиак».Что узнали? 1 уровень 1)Аммиак ____________ растворяется в воде. 2)Раствор аммиака в воде
- 32. 2 уровень 1)Молекула аммиака имеет неподелённую электронную пару: А. Одну Б. Две В. Три Г. Пять
- 33. Аммиак Газообразный Хорошорастворим Восстановитель при горении Образующий соль нашатырь Поражающий слизистые оболочки Поражает растения
- 35. Скачать презентацию













2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/385850/slide-21.jpg)








 Отчет
Отчет ГЕОГРАФИЯ
ГЕОГРАФИЯ Школа музыки GUITARDO
Школа музыки GUITARDO Презентация на тему Русская икона. Древнерусская живопись
Презентация на тему Русская икона. Древнерусская живопись Прочитай загадку, найди отгадку
Прочитай загадку, найди отгадку Два художника (Дружба Чехова и Левитана)
Два художника (Дружба Чехова и Левитана) Спирты
Спирты Презентация на тему Час общения «Времена года»
Презентация на тему Час общения «Времена года» Презентация на тему Платоники и Элидо-эритрийская школа
Презентация на тему Платоники и Элидо-эритрийская школа Стратегия муниципальных выборов в новой реальности
Стратегия муниципальных выборов в новой реальности Презентация на тему Этические правила служебного поведения и проф. служебной деятельности гос. гражданских служащих РФ
Презентация на тему Этические правила служебного поведения и проф. служебной деятельности гос. гражданских служащих РФ  НАИМЕНОВАНИЕ ОРГАНИЗАЦИИ КАК ПРЕДМЕТ Васильева Анна Сергеевна зав. сектором электронного каталога отдела научной обработки ф
НАИМЕНОВАНИЕ ОРГАНИЗАЦИИ КАК ПРЕДМЕТ Васильева Анна Сергеевна зав. сектором электронного каталога отдела научной обработки ф Презентация на тему Правила поведения на железной дороге (3 класс)
Презентация на тему Правила поведения на железной дороге (3 класс) ПОЛОЖЕНИЕ о выборах членовМолодежного парламентаМО «Увинский район»
ПОЛОЖЕНИЕ о выборах членовМолодежного парламентаМО «Увинский район» Мастер-класс Изготовление театральной куклы
Мастер-класс Изготовление театральной куклы The Family Law
The Family Law  Бойко Алесандра
Бойко Алесандра Elektron sənəd. Dövri̇yyəsi̇ si̇stemi̇
Elektron sənəd. Dövri̇yyəsi̇ si̇stemi̇ Правовые дебаты: «ЗА» и «ПРОТИВ»
Правовые дебаты: «ЗА» и «ПРОТИВ» Благотворительная программа «Подарим детям сказку»
Благотворительная программа «Подарим детям сказку» ЛУГАНСКАЯ ОБЛАСТЬ, УКРАИНА
ЛУГАНСКАЯ ОБЛАСТЬ, УКРАИНА Направления современной живописи
Направления современной живописи Натрий
Натрий Электронная физкультминутка boom-boom
Электронная физкультминутка boom-boom Царь Иван Грозный
Царь Иван Грозный Размещение рекламы в ВУЗах РФ
Размещение рекламы в ВУЗах РФ Психология общения Берн
Психология общения Берн «Моя математика» 1 класс
«Моя математика» 1 класс