высокую теплоту испарения, он легко сжимается. Хорошо растворим в воде: в 1V Н2O растворяется 750V NH3 (при t°=20°C и p=1 атм)В хорошей растворимости аммиака можно убедиться на следующем опыте. Сухую колбу наполняют аммиаком и закрывают пробкой, в которую вставлена трубка с оттянутым концом. Конец трубки опускают в воду и колбу немного подогревают. Объем газа увеличивается, и немного аммиака выйдет из трубки. Затем нагревание прекращают и, вследствие сжатия газа некоторое количество воды войдет через трубку в колбу. В первых же каплях воды аммиак растворится, в колбе создастся вакуум и вода, под влиянием атмосферного давления будет подниматься в колбу, - начнет "бить фонтан".
Благодаря водородным связям, аммиак имеет сравнительно высокие t°кип. и t°пл., а также высокую теплоту испарения, он легко сжимается. Хорошо растворим в воде: в 1V Н2O растворяется 750V NH3 (при t°=20°C и p=1 атм)В хорошей растворимости аммиака можно убедиться на следующем опыте. Сухую колбу наполняют аммиаком и закрывают пробкой, в которую вставлена трубка с оттянутым концом. Конец трубки опускают в воду и колбу немного подогревают. Объем газа увеличивается, и немного аммиака выйдет из трубки. Затем нагревание прекращают и, вследствие сжатия газа некоторое количество воды войдет через трубку в колбу. В первых же каплях воды аммиак растворится, в колбе создастся вакуум и вода, под влиянием атмосферного давления будет подниматься в колбу, - начнет "бить фонтан".
ПОЛУЧЕНИЕ
АММИАКА



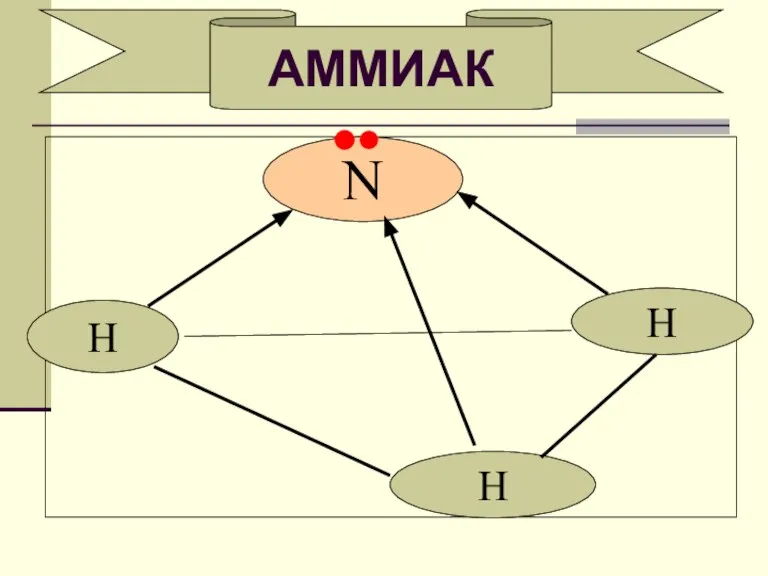

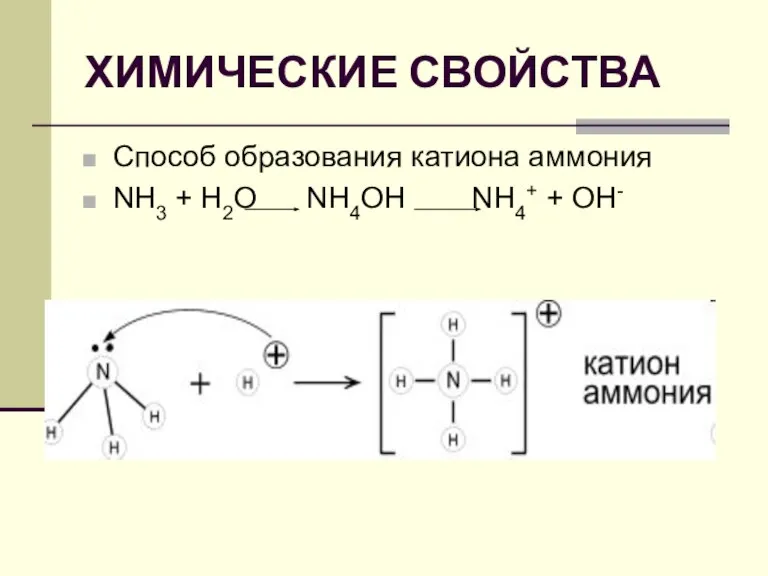

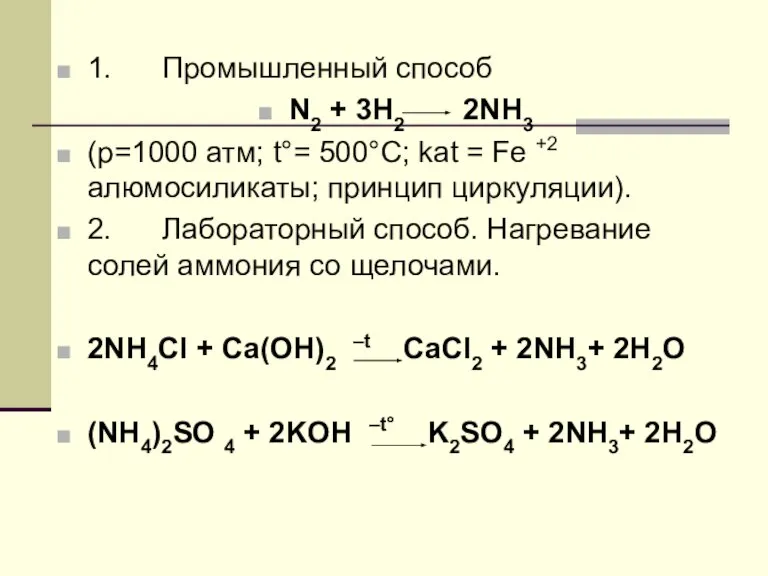
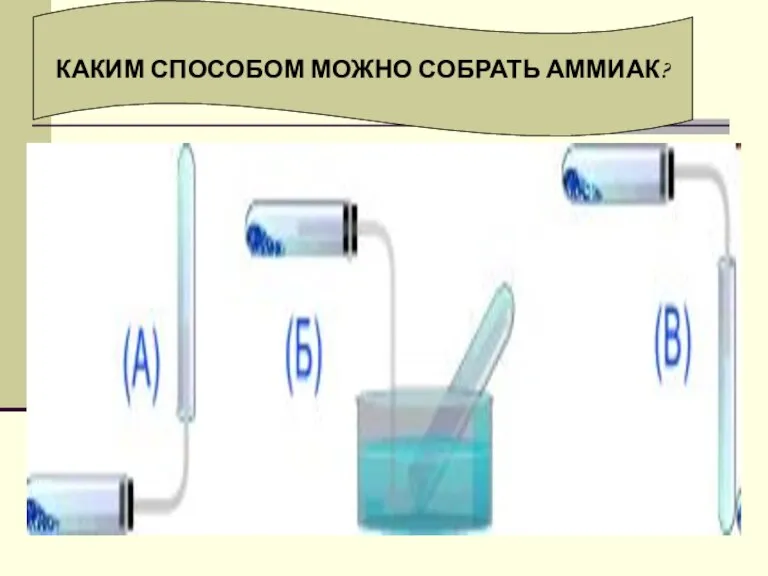




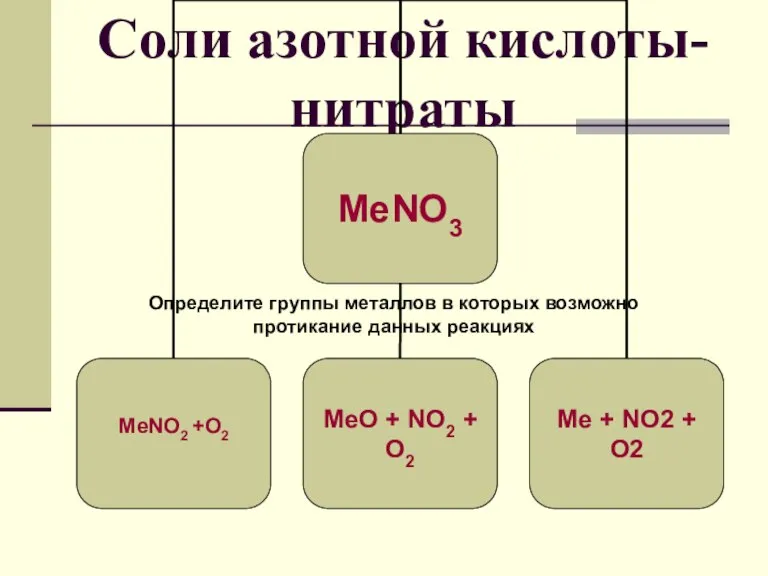



 Урок Политические режимы
Урок Политические режимы Магний
Магний наречие
наречие Презентация на тему Театрально-игровая деятельность - как средство развития творческих способностей детей дошкольного возраста
Презентация на тему Театрально-игровая деятельность - как средство развития творческих способностей детей дошкольного возраста Создание Свияжского межрегионального мультимодального логистического центра
Создание Свияжского межрегионального мультимодального логистического центра ООО Свет, дочерняя компания по производству и поставке насосного оборудования под торговой маркой Hiflow
ООО Свет, дочерняя компания по производству и поставке насосного оборудования под торговой маркой Hiflow Венский конгресс в истории Европы
Венский конгресс в истории Европы Программа «Лето- 2012»
Программа «Лето- 2012» Графическая часть проекта
Графическая часть проекта «Об отдельных вопросах исполнения краевого бюджета за первое полугодие 2009 года»
«Об отдельных вопросах исполнения краевого бюджета за первое полугодие 2009 года» Существующий распределительный механизм в пенсионной системе
Существующий распределительный механизм в пенсионной системе Tim Knowles
Tim Knowles Северный (Арктический) федеральный университет имени М.В.Ломоносова: приоритеты развития
Северный (Арктический) федеральный университет имени М.В.Ломоносова: приоритеты развития Подобные слагаемые 6 класс
Подобные слагаемые 6 класс Художественная обработка древесины
Художественная обработка древесины Барокко и классицизм в русской архитектуре XVIIIв
Барокко и классицизм в русской архитектуре XVIIIв Шифровальные устройства эпохи Возрождения
Шифровальные устройства эпохи Возрождения Россия - Родина моя
Россия - Родина моя Профессии, связанные с сельским хозяйством
Профессии, связанные с сельским хозяйством Возвращаясь домой в большом городе
Возвращаясь домой в большом городе Полиуретан
Полиуретан Торт Пряная груша-карамель-фундук
Торт Пряная груша-карамель-фундук Эскизирование детали Крышка
Эскизирование детали Крышка Федеральная налоговая служба
Федеральная налоговая служба Декоративный натюрморт
Декоративный натюрморт Общие принципы организации взаимодействия администраторов доходов бюджета с Государственной информационной системой о государс
Общие принципы организации взаимодействия администраторов доходов бюджета с Государственной информационной системой о государс Автоматы и пулеметы
Автоматы и пулеметы Рейтинговая система оценивания достижений учащихся
Рейтинговая система оценивания достижений учащихся