Содержание
- 2. Внимательно посмотрите на формулы приведенных оксидов: CaO, CO2, Al2O3, Mn2O7, N2O, P2O5, MgO, CO, SO2, SO3,
- 3. 1. Оксиды – это вещества простые или сложные? 2. Какой элемент обязательно входит в состав оксидов?
- 4. Попробуем составить определение класса оксидов Оксиды – это _____________ вещества, состоящие из _______ элементов, один из
- 5. Оксиды – это СЛОЖНЫЕ вещества, состоящие из ДВУХ элементов, один из которых КИСЛОРОД. Запомните определение!
- 6. Из предложенного перечня веществ выпишите только оксиды: SnO, NaOH, HCl, N2O5, Na2CO3, CO2, Cr2O3, CrSO4, Cu2O,
- 7. Проверяем: оксидами являются SnO, NaOH, HCl, N2O5, Na2CO3, CO2, Cr2O3, CrSO4, Cu2O, CuO, KCl, K2O, KOH,
- 8. Оксидами не являются: NaOH, Na2CO3, CrSO4, KOH, K3PO4, HNO3 так как состоят из трех элементов HCl,
- 9. Попробуем назвать оксиды СаО – оксид кальция Al2O3 – оксид алюминия Na2O – оксид натрия MgO
- 10. Однако, случается так, что один и тот же элемент образует несколько оксидов, например СО и СО2
- 11. А теперь потренируйтесь и назовите следующие оксиды: FeO Fe2O3 P2O3 P2O5 K2O SO2 SO3
- 12. Проверяем: FeO – оксид железа (II) Fe2O3 – оксид железа (III) P2O3 – оксид фосфора (III)
- 13. Наверное, вам хочется самим научиться составлять формулы оксидов. Для этого: 1. Запишите рядом символы элементов, помните,
- 14. Наверное, вам хочется самим научиться составлять формулы оксидов. 2. Определите наименьшее общее кратное чисел – значений
- 15. Наверное, вам хочется самим научиться составлять формулы оксидов. 3. Разделив наименьшее общее кратное на значение степени
- 16. Попробуйте составить формулы оксидов: Оксид цинка – Оксид азота (V) - Оксид хрома (III) – Оксид
- 17. Проверяем: Оксид цинка – ZnO Оксид азота (V) – N2O5 Оксид хрома (III) – Cr2O3 Оксид
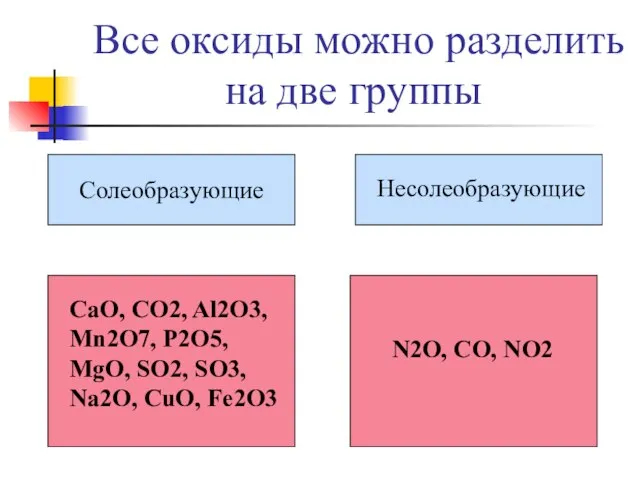
- 18. Все оксиды можно разделить на две группы Солеобразующие Hесолеобразующие CaO, CO2, Al2O3, Mn2O7, P2O5, MgO, SO2,
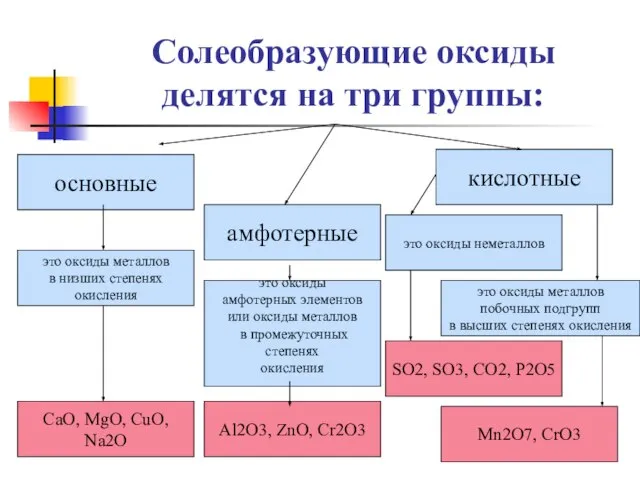
- 19. Солеобразующие оксиды делятся на три группы: основные амфотерные кислотные это оксиды металлов в низших степенях окисления
- 20. Выполни тест для закрепления темы 1. Оксидом является вещество: 1. MnCl2 3. MnO2 2. Mn(OH)2 4.
- 21. Выполни тест для закрепления темы 3. В ряду веществ, формулы которых K2O, Na2O, CuO 1. кислотные
- 22. Выполни тест для закрепления темы 5. Формулы кислотного и основного оксидов соответственно: 1. MnO, CaO 3.
- 24. Скачать презентацию



















 Услуга «Персональный ассистент»
Услуга «Персональный ассистент» Возможные дефекты облицовывания, их предупреждение и устранение
Возможные дефекты облицовывания, их предупреждение и устранение Основы проектной деятельности
Основы проектной деятельности Беспилотная доставка
Беспилотная доставка Картинг, от макета к реальности
Картинг, от макета к реальности Подготовка учащихся к олимпиадам по обществознанию праву, ЕГЭ и ОГЭ
Подготовка учащихся к олимпиадам по обществознанию праву, ЕГЭ и ОГЭ Уважаемые партнеры! Мы рады представить эксклюзивную новинку Color Symphony винил вспененный на флизелине1,06*10m
Уважаемые партнеры! Мы рады представить эксклюзивную новинку Color Symphony винил вспененный на флизелине1,06*10m Очищение и кондиционирование. Предложение для клиента
Очищение и кондиционирование. Предложение для клиента Разработка блок-схем в программе Microsoft Office Visio 2007
Разработка блок-схем в программе Microsoft Office Visio 2007 Вероятность прогноза температур рельсов
Вероятность прогноза температур рельсов Приемная кампания 2012
Приемная кампания 2012 Запрос и предложение - способ коммуникации между заказчиком и исследовательским агентством
Запрос и предложение - способ коммуникации между заказчиком и исследовательским агентством Развитие речи. Заметка. Герои Алтайской земли.
Развитие речи. Заметка. Герои Алтайской земли. Презентация на тему Формирование универсальных учебных действий в образовательном пространстве начальной школы в условиях внедр
Презентация на тему Формирование универсальных учебных действий в образовательном пространстве начальной школы в условиях внедр Презентация по информатике на тему: Поколение третье. Интегральные схемы.
Презентация по информатике на тему: Поколение третье. Интегральные схемы. Цех по изготовлению металлоконструкций п. Балезино. Бизнес-план
Цех по изготовлению металлоконструкций п. Балезино. Бизнес-план Презентация
Презентация Эмоционально-волевая реакция. Психофизиологические качества водителя
Эмоционально-волевая реакция. Психофизиологические качества водителя Создание изображения для фона презентации
Создание изображения для фона презентации Восстановление славянских государств
Восстановление славянских государств Масла индустриальные ГОСТ 17479.4-87
Масла индустриальные ГОСТ 17479.4-87 Симметрия в живой и неживой природе Выполнили: студенты 1-го курса Факультет: Таможенное дело Группа: Т-116с. Уваров Антон, Панкрат
Симметрия в живой и неживой природе Выполнили: студенты 1-го курса Факультет: Таможенное дело Группа: Т-116с. Уваров Антон, Панкрат МОУ Медведская ООШ ФГОС начальная школа
МОУ Медведская ООШ ФГОС начальная школа Социальные нормы и социальный контроль
Социальные нормы и социальный контроль .
. Презентация
Презентация Самая большая ошибка человека
Самая большая ошибка человека Neizvedannye_zemli
Neizvedannye_zemli