Слайд 2Электрический ток в металлах

Слайд 3Электрический ток в металлах представляет собой упорядоченное движение свободных электронов

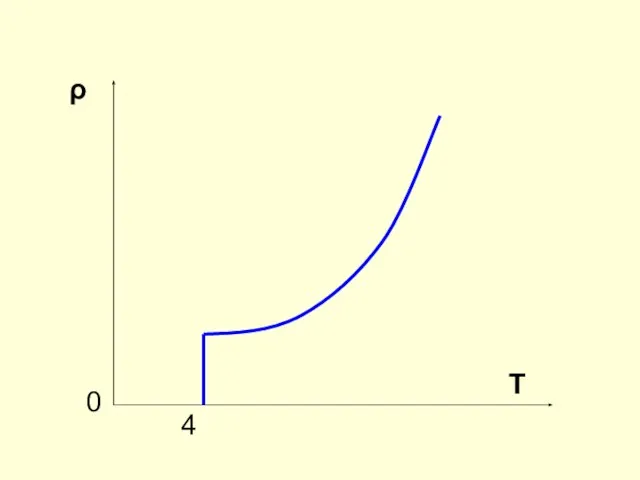
Слайд 4Зависимость сопротивления проводника от температуры
ρ = ρ0 (1 + άΔТ)

Слайд 5СВЕРХПРОВОДИМОСТЬ
1911 г. – Камерлинг-Оннес
При охлаждении ртути в жидком гелии ее сопротивление постепенно

уменьшается, а при температуре 4,1 К резко падает до нуля.
Слайд 7Применение сверхпроводников:
Мощные электромагниты, работающие без затрат энергии. (Ускорители элементарных частиц.)
Если бы удалось

создать сверхпроводящие материалы при температурах, близких к комнатным – стала бы возможна передача электроэнергии без потерь.
Слайд 81986 г. – открыта высокотемпературная сверхпроводимость (Т ~ 100К)
Электротехника
Радиотехника
Компьютерные технологии

Слайд 9Электрический ток в жидкостях

Слайд 10Жидкости:
проводники (растворы кислот, щелочей и солей);
диэлектрики (дистиллированная вода, керосин …)
полупроводники (расплавы сульфидов,

расплавленный селен).
Слайд 11Электролитическая диссоциация
Образование заряженных частиц в растворах и расплавах кислот, щелочей и солей.

Слайд 12Степень диссоциации (доля молекул, распавшихся на ионы)
Зависит от:
концентрации раствора;
диэлектрической проницаемости раствора;
температуры (с

увеличением температуры – возрастает).
Слайд 13Электрический ток в жидкостях
Направленное движение положительных ионов к катоду и отрицательных ионов

к аноду
В жидких металлах – движение положительных ионов к катоду и электронов к аноду.
Слайд 14Электролиз
Процесс выделения на электродах вещества, связанный с окислительно – восстановительными реакциями.

Слайд 16Масса вещества, выделяющегося на электродах за время Δt
М. Фарадей 1836 г.
k –

электрохимический эквивалент вещества.
Слайд 17
Масса вещества, выделившегося на электроде при переносе через раствор заряда 1 Кл.
Отношение

массы иона вещества к его заряду.
Слайд 18Постоянная Фарадея
Заряд, который надо пропустить через раствор 1-валентного в-ва, чтобы на электроде

выделилось 1 моль вещества.
Слайд 19 F = 9,65*104 Кл/моль
- для одновалентного вещества
Для выделения на электроде 1

моля n – валентного вещества, необходимо пропустить заряд, численно равный произведению nF.
Слайд 20Применение электролиза
Гальваностегия (нанесение покрытий).
Гальванопластика (изготовление копий с рельефных предметов).
Рафинирование (очистка) металлов.
Получение чистых

металлов из расплавов природных соединений.

















 (–1) · 3 =
(–1) · 3 = Осмотр общего имущества в многоквартирном доме
Осмотр общего имущества в многоквартирном доме EV3 Самосвал
EV3 Самосвал Инвестиционный фонд МАП «Инновационный лифт»
Инвестиционный фонд МАП «Инновационный лифт» Нам нужны союзники!
Нам нужны союзники! Дисциплина: Международные перевозки грузов РАЗДЕЛ 3. Обеспечивающий комплекс организации международной перевозки грузов Тема 3
Дисциплина: Международные перевозки грузов РАЗДЕЛ 3. Обеспечивающий комплекс организации международной перевозки грузов Тема 3 Мое зазеркалье
Мое зазеркалье Московский колледж бизнес-технологий. Эксплуатация беспилотных авиационных систем
Московский колледж бизнес-технологий. Эксплуатация беспилотных авиационных систем Презентация Microsoft PowerPoint (3)
Презентация Microsoft PowerPoint (3) Презентация на тему Иудаизм презентация 4 класс
Презентация на тему Иудаизм презентация 4 класс Структура Аппарата Правительства Кыргызской Республики
Структура Аппарата Правительства Кыргызской Республики Автоматизированная информационная система «Государственный заказ»
Автоматизированная информационная система «Государственный заказ» Формирование экологической культуры обучающихся колледжа через реализацию социально-образовательых проектов
Формирование экологической культуры обучающихся колледжа через реализацию социально-образовательых проектов Тема урока «Право на труд. Трудовые правоотношения»
Тема урока «Право на труд. Трудовые правоотношения» Класс 1-1 3주 후 시험문제 읽기 Чтение
Класс 1-1 3주 후 시험문제 읽기 Чтение Обобщающий урок - игра по теме: «Я знаю край родной».
Обобщающий урок - игра по теме: «Я знаю край родной». Тяжелая атлетика в России и за рубежом
Тяжелая атлетика в России и за рубежом Разработка мероприятия Цифровой текстиль. Синтетические ткани
Разработка мероприятия Цифровой текстиль. Синтетические ткани Лекция_6 ЭТД ФТД.ppt
Лекция_6 ЭТД ФТД.ppt Презентация на тему Сочинение по картине Левитана «Весна. Большая вода» 4 класс
Презентация на тему Сочинение по картине Левитана «Весна. Большая вода» 4 класс Методы мониторинга репутациив социальных медиа
Методы мониторинга репутациив социальных медиа Областной конкурспервичных профсоюзныхорганизаций.
Областной конкурспервичных профсоюзныхорганизаций. Контроль квалификации сварщиков. Система аттестации сварочного производства
Контроль квалификации сварщиков. Система аттестации сварочного производства Уголовное законодательство Республики Казахстан на страже воинского правопорядка (занятие 1)
Уголовное законодательство Республики Казахстан на страже воинского правопорядка (занятие 1) 36736
36736 Презентация на тему Разгром империи Наполеона. Венский конгресс (8 класс)
Презентация на тему Разгром империи Наполеона. Венский конгресс (8 класс) Электрическая лампа накаливания
Электрическая лампа накаливания 20161206_avstraliya-i-okeaniya
20161206_avstraliya-i-okeaniya