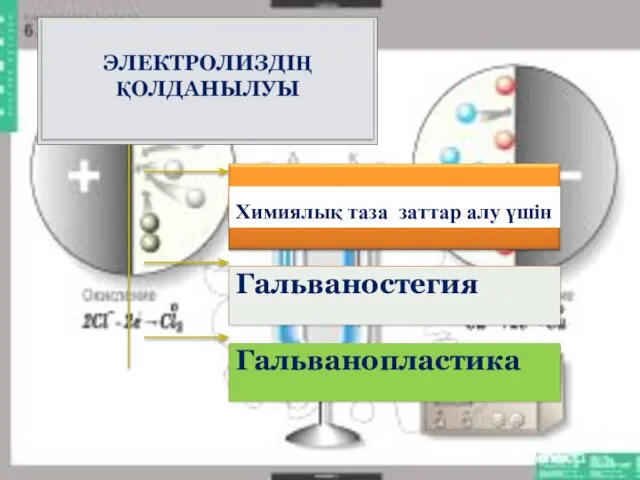
Содержание
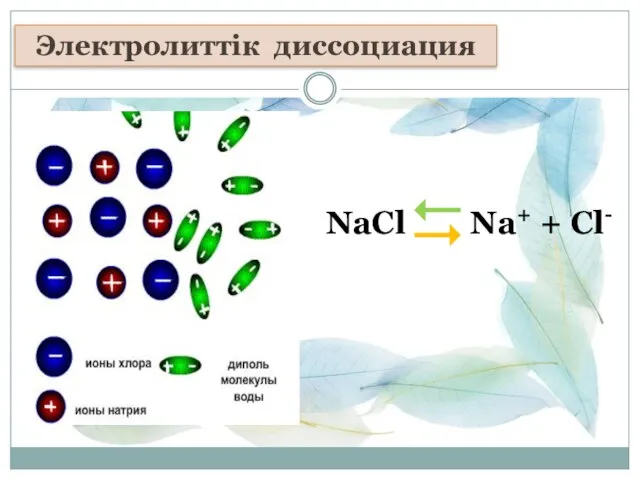
- 2. NaCl Na+ + Cl- Электролиттік диссоциация
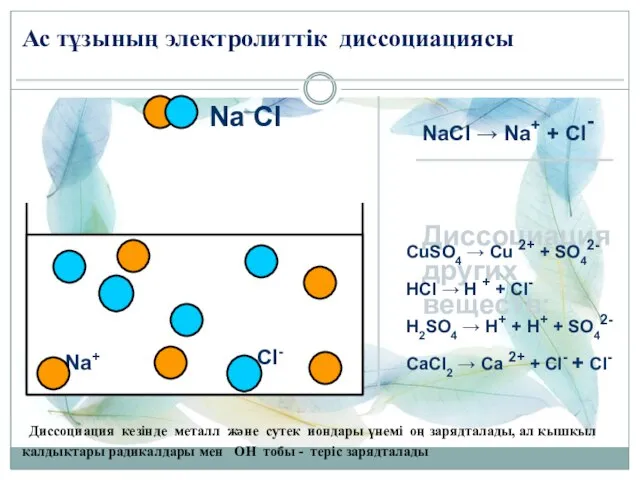
- 3. Na Cl Na+ Cl- Ас тұзының электролиттік диссоциациясы NaCl → Na+ + Cl- Диссоциация других веществ:
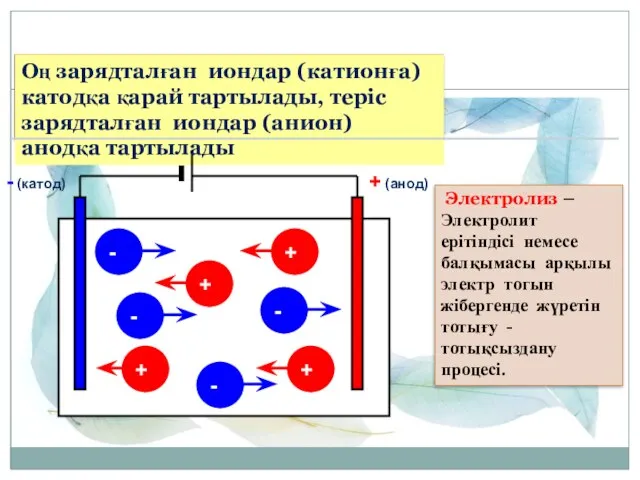
- 4. + (анод) - (катод) + + + - - - + - Электролиз – Электролит ерітіндісі
- 5. Электролиз - тотығу – тотықсыздану реакциясының әсерінен электродтарда таза заттардың алыну процесі.
- 6. Фарадей заңы Электролиз кезінде электродта бөлінген заттың массасы электролит арқылы өткен зарядтың мәніне тура пропорционал болады.
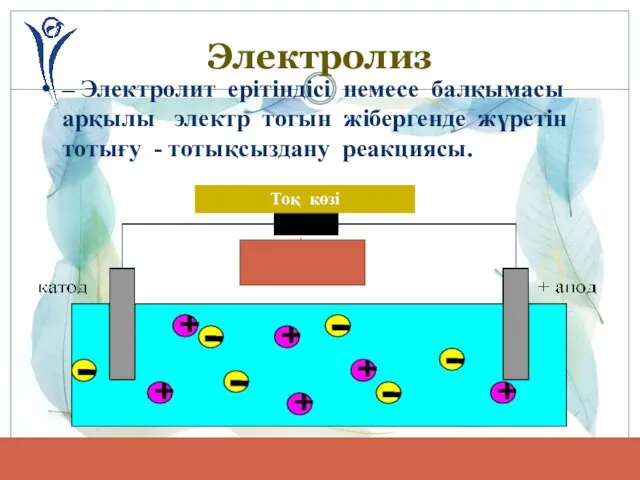
- 7. Электролиз – Электролит ерітіндісі немесе балқымасы арқылы электр тогын жібергенде жүретін тотығу - тотықсыздану реакциясы. Тоқ
- 8. 1834 жылы ағылшын ғалымы Майкл Фарадей электролиз зерттеп, оның заңдылықтарын ашты. Майкл Фарадей (1791 – 1867)
- 9. Ғылымға үлесі 1820 ж. – магнетизмді зерттеді. 1821 ж. – электродвигательдің физикалық негізін түсіндірді. 1831 ж.
- 10. Электролиздің екінші заңы Электр тогының бірдей мөлшерінде (электролит арқылы өткен электр заряды) электролиз кезінде бөлінген заттардың
- 11. Күміс нитратының сулы ерітіндісінің электролизі кезінде анодта 6 г оттек газы бөлінетін болса, катодта бөлінген күмістің
- 12. Зауытта массасы 468 кг натрий хлоридінің ерітіндісін электролизге ұшыратты. Алынған газдар хлорсутектің синтезі үшін қолданылады. Алынған
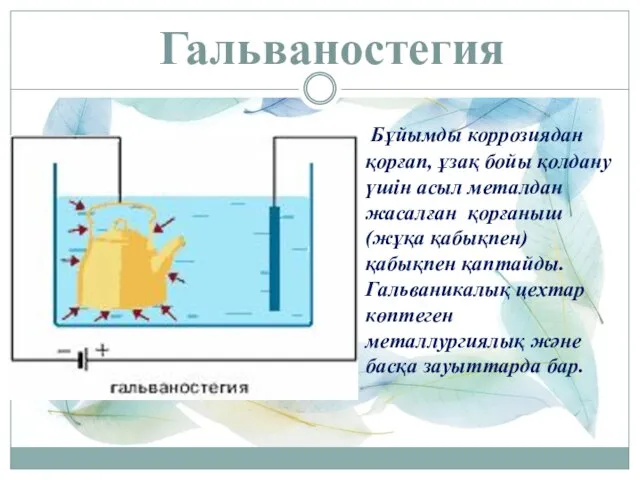
- 14. Гальваностегия Бұйымды коррозиядан қорғап, ұзақ бойы қолдану үшін асыл металдан жасалған қорғаныш (жұқа қабықпен) қабықпен қаптайды.
- 15. Бұйымдарды асыл металдан жасалған қорғаныш қабықпен қаптау
- 18. ГАЛЬВАНОПЛАСТИКА Электрлік әдіспен қалың қабатты (бірнеше миллиметрге дейін) көшірмелер алу. Гальванопластика әдісімен алынған барельефа, көшірмесі
- 19. Медаль мен тиындар жасау үшін қолданылады
- 20. Қысқы сарай
- 21. Үлкен театр
- 22. Типографияға қажетті бұйымдар
- 23. Пресс-формы из пластмассы, резины, металла
- 25. Скачать презентацию
















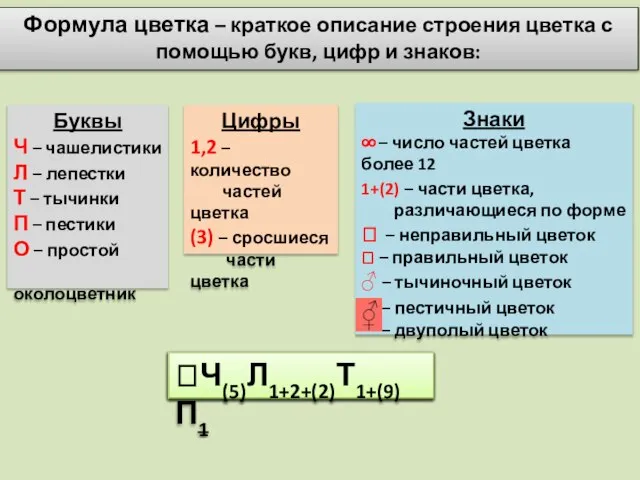 Формула цветка
Формула цветка Как составить резюме? Практические рекомендации
Как составить резюме? Практические рекомендации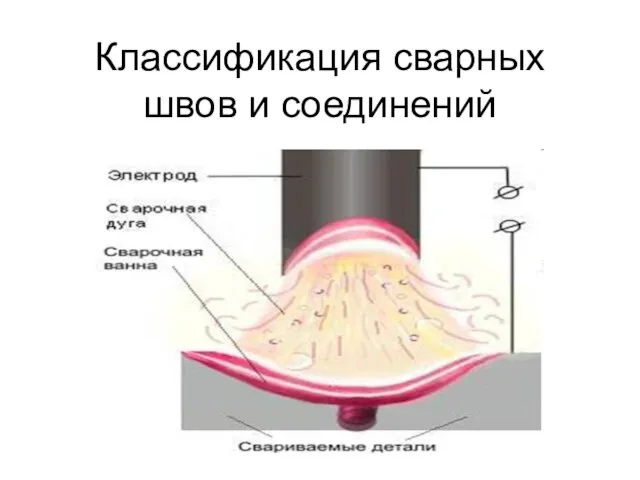 Классификация сварных швов и соединений
Классификация сварных швов и соединений Пути экономии энергии
Пути экономии энергии По волнам памяти
По волнам памяти Европейский Союз
Европейский Союз Презентация на тему Что такое туман
Презентация на тему Что такое туман Методика расследования карманных краж
Методика расследования карманных краж Презентация на тему Аутэкология. Факторная экология
Презентация на тему Аутэкология. Факторная экология EQUIVALENCE and TRANSLATION
EQUIVALENCE and TRANSLATION The draw
The draw AIRCRAFT ENGINES
AIRCRAFT ENGINES Рыба, запечённая с гречкой и тёртым сыром в сметанном соусе
Рыба, запечённая с гречкой и тёртым сыром в сметанном соусе I
I История национального костюма
История национального костюма Авторские таблицы к разделу Искусство народов разных стран. Греция
Авторские таблицы к разделу Искусство народов разных стран. Греция Театральная студия Солнышко
Театральная студия Солнышко Модель организации образовательного процесса до ФГТ Самостоятельная деятельность Совместная деятельность Занятия.
Модель организации образовательного процесса до ФГТ Самостоятельная деятельность Совместная деятельность Занятия. Интегрированное региональное исследование окружающей среды Сибири: первые шаги и уроки
Интегрированное региональное исследование окружающей среды Сибири: первые шаги и уроки Выпечка
Выпечка Овощи: характеристика и общие свойства
Овощи: характеристика и общие свойства Животные Сибири
Животные Сибири Детская Художественная Школа №1
Детская Художественная Школа №1 Презентация на тему Стекло история открытия и получение
Презентация на тему Стекло история открытия и получение  Конфликт. Его виды, примеры
Конфликт. Его виды, примеры Программа (концепция) развития муниципального образования Завьяловский район версия 1.0
Программа (концепция) развития муниципального образования Завьяловский район версия 1.0 Our impact
Our impact Novy_dokument_v_formate_RTF
Novy_dokument_v_formate_RTF